(届上海市六校高三第二次联考化学试卷)
铁盐、亚铁盐在工农业生产、生活、污水处理等方面有着极其广泛的应用.
(一)用铁屑与硫酸反应制备FeSO4
已知4Fe2++O2+4H+= 4Fe3++2H2O。FeSO4在水中的溶解度见图。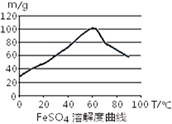
(1)首先,将铁屑放入碳酸钠溶液中煮沸除油污,分离出液体,用水洗净铁屑。此步骤中,分离出液体的方法通常不用过滤,使用的操作是____________(填写操作名称)。
(2)向处理过的铁屑中加入适量的硫酸,在一定温度下使其反应到不再产生气体,趁热过滤,得FeSO4溶液。此处:硫酸浓度应选择
| A.浓硫酸 | B.10moL/L硫酸 | C.3moL/L硫酸 | D.任意浓度硫酸; |
温度宜控制在______;加热的同时需适当补充水,原因是 。反应中应保持n(Fe)/n(H2SO4) 1(填“<”、“>”或“=”)。
(3)亚铁盐在空气中易被氧化,但形成复盐可稳定存在。如“摩尔盐”,即硫酸亚铁铵[(NH4)2SO4•FeSO4•6H2O],就是在FeSO4溶液中加入少量稀H2SO4溶液,再加入饱和(NH4)2SO4溶液,经过蒸发浓缩、冷却结晶、过滤等一系列操作后所得。过程中稀硫酸的作用是 。
(二)用含有少量Al的废铁屑制备Fe2(SO4)3其操作流程及有关资料如下: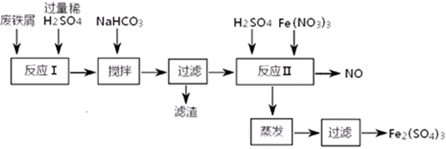
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Al(OH)3 |
| 开始沉淀 |
2.3 |
7.5 |
3.4 |
| 完全沉淀 |
3.2 |
9.7 |
4.4 |
(4)加NaHCO3时,混合液pH值应控制在_______________________。
(5)反应Ⅱ中反应的离子方程式是:___________________。
(6)实际生产中,将反应Ⅱ产生的NO配比一种气体X,混合后重新通入反应Ⅱ中,该设计的目的是________,气体X与NO配比的比例是_____________。
一氧化碳与水蒸气的反应为CO(g) + H2O(g)  CO2(g) + H2(g)在密闭容器中,将1.0 mol CO与1.0mol H2O混合加热到434℃,在434℃的平衡常数K1 =9
CO2(g) + H2(g)在密闭容器中,将1.0 mol CO与1.0mol H2O混合加热到434℃,在434℃的平衡常数K1 =9
(1)跟踪测定H2O的物质的量浓度,如图所示,则0 —20 min ,H2O的反应速率是
(2)请在图中用实线绘制出在该温度下加入正催化剂后,H2O的物质的量浓度变化图线。
(3)从434℃升温至800℃,800℃的平衡常数K2 =1,则正反应为_____________(填“放
热反应”或“吸热反应”或“不能确定”)。
(4)求在800℃反应达平衡时,CO转化为CO2的转化率(写出必要的计算过程)
氨是最重要的氮肥原料。在课本里学到的合成氨技术叫哈伯法,近一个世纪,合成氨需要高温高压似乎是天经地义了。然而,最近有两位希腊化学家在《科学》杂志上发表文章说,在常压下把氢气和用氦气稀释的氮气分别通入一个加热到570℃的电解池(如图),氢气和氮气便可在电极上合成氨,转化率竟然高达78%。
请根据以上材料回答下列问题:
(1)写出哈伯法合成氨的化学方程式:;其反应条件中,符合平衡移动原理的反应条件是
(2)新法合成氨的电解池中能否用水溶液作电解质?(填“能”、“不能”)
为什么?
(3)电解池中,阳极发生(填得或失)电子氧化反应,变价元素化合价(填升高或降低)
(4)新法合成氨中所用的电解质(如图中黑细点所示)能传导H+,试写出电极反应式和总反应式。阳极:;阴极___________________________
总反应式:__________________________________。
(18分)芳香族化合物在生产生活中有广泛的用途。
Ⅰ。实验室一试剂瓶标签严重破损,只能隐约看到一部分: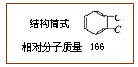
取该试剂瓶中的试剂,通过燃烧实验测得:16.6g该物质完全燃烧得到39.6g CO2 与9g H2O。
(1)通过计算可知该有机物的分子式为:。
(2)进一步实验可知:①该物质能与碳酸氢钠溶液反应生成无色无味气体。②16.6g该物质与足量NaOH反应,消耗0.1mol NaOH。请写出一种符合该物质结构的结构简式:
Ⅱ。滴露是一种常用消毒剂。它的主要成分结构如下图: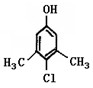
(1)它具有的官能团的名称:
(2)该分子在核磁共振氢谱图中显示出种峰,其峰面积比为
(3)写出它与氢氧化钠溶液反应的化学方程式
Ⅲ。多巴胺是在大脑的相应部位传递快乐信息化学物质,结构如下图: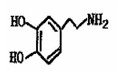
(1)多巴胺可由香兰素与硝基甲烷缩合,再经锌还原水解而得。合成过程示如下: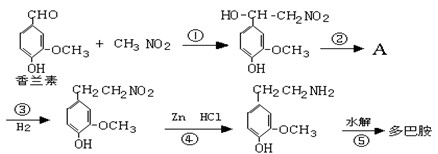
写出上述过程中①的反应类型:
写出②、⑤两步的化学方程式:
②:
⑤:
(2)写出香兰素的银镜反应的化学方程式
(3)写出符合下列条件的香兰素的所有同分异构体的结构简式:①苯环上有两个取代基,其苯环上的一溴代物有两种;②能发生水解反应;③显弱酸性
下表列出了部分常见含有10电子和18电子的粒子,回答下列问题。
| 10电子粒子 |
CH4、NH3、H2O、HF、Na+、Al3+、NH4 +、OH- |
| 18电子粒子 |
H2S、HCl、K+ 、Cl-、C2H6…… |
(1)表中-1价的简单离子在周期表中的位置是(周期、族)。其单质有毒,常用强碱溶液吸收,反应的离子方程式为
(2)表中水溶液显碱性的分子的电子式是
写出其催化氧化的化学方程式
(3)写出由表中两种10电子粒子相互反应,生成两种10电子粒子的离子方程式
。
(4)表中在水溶液中能够促进水电离的粒子有
(5)由表中离子组成的NaOH是常用的试剂,下图是配置一定物质的量浓度的氢氧化钠溶液的操作图示,整个过程分为①②③④⑤⑥六个单元。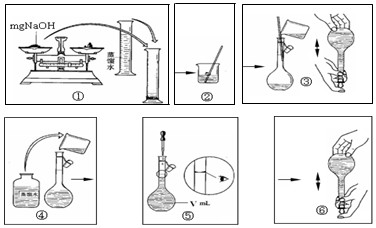
其中操作有错误的单元有(选填①②……)
(6)由第二周期元素形成的氢化物A和B都含有18电子, A是一种6原子分子,可做火箭发动机的燃料,B是一种常见强氧化剂。已知16g液态A与液态B充分反应生成一种液态10电子分子和一种气态单质,并放出838 kJ热量。写出A与B反应的热化学方程式
按要求进行书写:
(1)氯化钡的电离方程式:___________
(2)氢氧化亚铁在空气中被氧化的化学方程式:___________
(3)过氧化钠与水反应的化学方程式:___________
(4)在化学方程式上用双线桥法表示电子转移的方向及数目:
MnO2+4HCl(浓) MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑