氨是最重要的氮肥原料。在课本里学到的合成氨技术叫哈伯法,近一个世纪,合成氨需要高温高压似乎是天经地义了。然而,最近有两位希腊化学家在《科学》杂志上发表文章说,在常压下把氢气和用氦气稀释的氮气分别通入一个加热到570℃的电解池(如图),氢气和氮气便可在电极上合成氨,转化率竟然高达78%。
请根据以上材料回答下列问题:
(1)写出哈伯法合成氨的化学方程式: ;其反应条件中,符合平衡移动原理的反应条件是
(2)新法合成氨的电解池中能否用水溶液作电解质? (填“能”、“不能”)
为什么?
(3)电解池中,阳极发生 (填得或失)电子氧化反应,变价元素化合价 (填升高或降低)
(4)新法合成氨中所用的电解质(如图中黑细点所示)能传导H+,试写出电极反应式和总反应式。阳极: ;阴极___________________________
总反应式:__________________________________。
运用化学反应原理知识研究如何利用CO、SO2等污染物有重要意义。
(1)用CO可以合成甲醇。已知:
CH3OH(g)+ O2(g)===CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1
O2(g)===CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1
CO(g)+ O2(g)===CO2(g)ΔH=-283.0 kJ·mol-1
O2(g)===CO2(g)ΔH=-283.0 kJ·mol-1
H2(g)+ O2(g)===H2O(l)ΔH=-285.8 kJ·mol-1
O2(g)===H2O(l)ΔH=-285.8 kJ·mol-1
则CO(g)+2H2(g)  CH3OH(g) ΔH=________kJ·mol-1
CH3OH(g) ΔH=________kJ·mol-1
(2)下列措施中能够增大上述合成甲醇反应的反应速率的是________(填写序号).
a.使用高效催化剂 b.降低反应温度
c.增大体系压强 d.不断将CH3OH从反应混合物中分离出来
(3)在一定压强下,容积为V L的容器中充入a mol CO与2a mol H2,
在催化剂作用下反应生成甲醇,
平衡转化率与温度、压强的关系如图所示。
①p1________p2(填“大于”、“小于”或“等于”);
②100 ℃时,该反应的化学平衡常数K=________(mol·L-1)-2;
③在其它条件不变的情况下,再增加a mol CO和2a molH2,达到新平衡时,CO的转化率________(填“增大”、“减小”或“不变”)。
(4)某科研小组用SO2为原料制取硫酸。
①利用原电池原理,用SO2、O2和H2O来制备硫酸,该电池用多孔材料作电极,它能吸附气体,同时也能使气体与电解质溶液充分接触。请写出该电池的负极的电极反应式________________。
②用Na2SO3溶液充分吸收SO2得NaHSO3溶液,然后电解该溶液可制得硫酸。电解原理示意图如下图所示。
请写出开始时阳极反应的电极反应式________________。
工业上用某矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)提取铜的操作流程如下(金属单质E可由滤液C制取):已知:Cu2O+2H+===Cu2++Cu+H2O。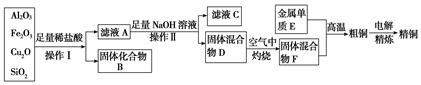
(1)滤液A中铁元素的可能存在形式为________(填离子符号),与之相关的离子方程式为;。
若滤液A中存在Fe3+,检验该离子的试剂为________(填试剂名称)。
(2)写出E和F反应生成铜的化学方程式为。
(3)利用电解法进行粗铜精炼时,下列叙述正确的是________(填序号)。
a.若用硫酸铜溶液作电解液, 向阴极移动
向阴极移动
b.粗铜接电源正极,发生还原反应
c.精铜作阴极,电解后电解液中Cu2+浓度减小
d.当粗铜消耗6.4 g时,转移0.2NA个电子
Z、Y、X、W、V是原子序数依次增大的五种常见元素。X元素是地壳中含量最多的元素,Y、Z组成的气态化合物M的水溶液呈碱性,W的单质在X2中燃烧产物可使品红溶液褪色,V是一种历史悠久、应用广泛的金属元素。请回答:
(1)Y元素在周期表中的位置是;M的分子空间构型为形,M是分子(“极性”或“非极性”)
(2)写出X、Z两种元素组成的化合物Z2X2的结构式:。
(3)由以上五种元素两两组合所形成的化合物中,有一种物质能与水反应生成气体且反应属于氧化还原反应,请写出该反应的化学方程式。
(4)X、Y、Z三种元素可组成一种强酸U,M与U反应生成一种盐K,写出K中含有的化学键类型。
(5)若将V金属投入到盐酸溶液中,生成了浅绿色溶液N。N的酸性溶液与双氧水反应的离子方程式:。
(每空2分,共10分)
研究CO2的利用对促进低碳社会的构建具有重要意义。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
已知:Fe2O3(s) + 3C(石墨) =" 2Fe(s)" + 3CO(g) △H 1 =" +489.0" kJ·mol-1
C(石墨) +CO2(g) = 2CO(g) △H 2 =" +172.5" kJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为。
(2)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:
CO2(g) +3H2(g) CH3OH(g) +H2O(g) △H
CH3OH(g) +H2O(g) △H
①该反应的平衡常数表达式为K=。
②取一定体积CO2和H2的混合气体(物质的量之比为1∶3),加入恒容密闭容器中,发生上述反应。反应经过相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系如图1所示,则该反应的ΔH0(填“>”、“<”或“=”)。
③在两种不同温度下发生反应,测得CH3OH的物质的量随时间变化如图2所示,曲线I、Ⅱ对应的平衡常数大小关系为KⅠKⅡ(填“>”、“<”或“=”)。
④用硫酸溶液作电解质进行电解,CO2在电极上可转化为甲烷,该电极反应的方程式为。
(共8分)
某无色溶液,其中可能存在Na+、Ba2+、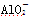 、S2-、
、S2-、 、
、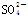 。取该溶液进行有关实验,实验结果如图所示。
。取该溶液进行有关实验,实验结果如图所示。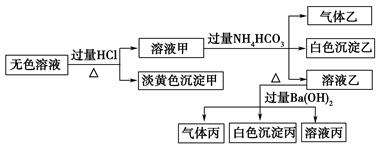
请回答下列问题:
(1)沉淀甲的化学式为________,白色沉淀乙的化学式为________
(2)由溶液甲生成沉淀乙的离子方程式为__________________。
(3)沉淀丙中一定含有_________(填化学式,下同),可能含有_______________。
(4)综合上述信息,该溶液中肯定存在的离子有_____________。