运用化学反应原理知识研究如何利用CO、SO2等污染物有重要意义。
(1)用CO可以合成甲醇。已知:
CH3OH(g)+ O2(g)===CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1
O2(g)===CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1
CO(g)+ O2(g)===CO2(g)ΔH=-283.0 kJ·mol-1
O2(g)===CO2(g)ΔH=-283.0 kJ·mol-1
H2(g)+ O2(g)===H2O(l)ΔH=-285.8 kJ·mol-1
O2(g)===H2O(l)ΔH=-285.8 kJ·mol-1
则CO(g)+2H2(g)  CH3OH(g) ΔH=________kJ·mol-1
CH3OH(g) ΔH=________kJ·mol-1
(2)下列措施中能够增大上述合成甲醇反应的反应速率的是________(填写序号).
a.使用高效催化剂 b.降低反应温度
c.增大体系压强 d.不断将CH3OH从反应混合物中分离出来
(3)在一定压强下,容积为V L的容器中充入a mol CO与2a mol H2,
在催化剂作用下反应生成甲醇,
平衡转化率与温度、压强的关系如图所示。
①p1________p2(填“大于”、“小于”或“等于”);
②100 ℃时,该反应的化学平衡常数K=________(mol·L-1)-2;
③在其它条件不变的情况下,再增加a mol CO和2a molH2,达到新平衡时,CO的转化率________(填“增大”、“减小”或“不变”)。
(4)某科研小组用SO2为原料制取硫酸。
①利用原电池原理,用SO2、O2和H2O来制备硫酸,该电池用多孔材料作电极,它能吸附气体,同时也能使气体与电解质溶液充分接触。请写出该电池的负极的电极反应式________________。
②用Na2SO3溶液充分吸收SO2得NaHSO3溶液,然后电解该溶液可制得硫酸。电解原理示意图如下图所示。
请写出开始时阳极反应的电极反应式________________。
实验室需要0.1 mol/L NaOH溶液450 mL,需要0.5 mol/L硫酸溶液500 mL.根据这两种溶液的配制情况回答下列问题: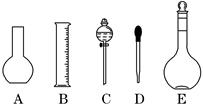
(1)如图所示的仪器中配制溶液肯定不需要的是 (填序号),配制上述溶液还需用到的玻璃仪器是 (填仪器名称).
(2)根据计算用托盘天平称取NaOH的质量为 g.
(3)根据计算得知,所需质量分数为98%、密度为1.84 g/cm3的浓硫酸的体积为
mL(计算结果保留一位小数).如果实验室有15 mL、20 mL、50 mL量筒,应选用 mL的量筒最好.配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是。
(4)取用任意体积的所配0.5 mol/L硫酸溶液时,下列物理量中不随所取体积的多少而变化的是(填字母)
A.溶液中H2SO4的物质的量 B.溶液的浓度
C.溶液中SO42-的数目 D.溶液的密度
(5)将所配制的稀H2SO4进行测定,发现浓度大于0.5mol/L。请你分析下列哪些操作会引起所配浓度偏大(填写字母)。
A.烧杯未进行洗涤
B.配制前,容量瓶中有少量蒸馏水
C.浓硫酸在烧杯中稀释后,未冷却就立即转移到容量瓶中,并进行定容;
D.往容量瓶转移时,有少量液体溅出
E.用量筒量取浓硫酸时,仰视量筒的刻度
F.在容量瓶中定容时俯视容量瓶刻度线
G.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线。
全球气候变暖已经成为全世界人类面临的重大问题,温家宝总理在“哥本哈根会议”上承诺到2020年中国减排温室气体40%。 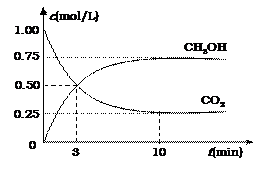
⑴ 地球上的能源主要源于太阳,绿色植物的光合作用可以大量吸收CO2以减缓温室效应,主要过程可以描述分为下列三步(用“C5”表示C5H10O4,用“C3”表示C3H6O3):
Ⅰ、H2O(l)=2H+(aq)+1/2O2(g)+2e-△H=+284kJ·mol-1
Ⅱ、CO2(g)+C5(s)+2H+(aq)=2C3+(s)△H=+396kJ·mol-1
Ⅲ、12C3+(s)+12e-=C6H12O6(葡萄糖、s)+6C5(s)+3O2(g)△H=-1200 kJ·mol-1
写出绿色植物利用水和二氧化碳合成葡萄糖并放出氧气的热化学方程式
。
⑵ 降低大气中CO2的含量及有效地开发利用CO2,目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1 L的恒容密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)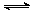 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
△H=-49.0 kJ·mol-1。测得CO2和CH3OH(g)的浓度随时间变化如图所示。
①从反应开始到平衡,氢气的平均反应速率
v(H2)=mol·(L·min)-1;
② 氢气的转化率=;
③ 该反应的平衡常数为(保留小数点后2位);
④ 下列措施中能使平衡体系中n(CH3OH)/n(CO2)增大的是。
| A.升高温度 | B.充入He(g),使体系压强增大 |
| C.将H2O(g)从体系中分离出去 | D.再充入1mol CO2和3mol H2 |
如图2-17,E为沾有Na2SO4溶液的滤纸,并加入几滴酚酞。A,B分别为Pt片,压在滤纸两端,R、S为电池的电极。M、N是用多微孔的Ni的电极材料,它在碱溶液中可以视为惰性电极。G为电流计,K为开关。C、D和电解池中都充满浓KOH溶液。若在滤纸中央点上一滴紫色的KMnO4溶液,K打开,接通电源一段时间后,C、D中有气体产生。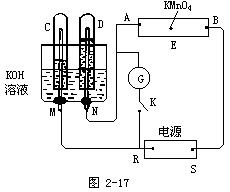
(1)外电源的正、负极分别是R为,S。
(2)A附近溶液的现象是,B附近发生的电极反应式为 .
(3)滤纸上的紫色点向哪方移动(填A、B)。
(4)当C、D里的气体产生到一定量时,切断外电源并接通开关K,经过一段时间,C、D中气体逐渐减少,主要因为,两极有关的反应式为
汽车尾气(含烃类、CO、NO与SO2等)是城市主要污染源之一,治理的办法之一是在汽车排气管上装催化转化器,它使NO与CO反应生成可参与大气生态循环的无毒气体,反应原理:2NO(g)+2CO(g)===N2(g)+2CO2(g),在298 K、100 kPa下,ΔH=-113 kJ·mol-1,ΔS=-145 J·(mol·K)-1.
(1)为了提高该反应的速率和NO的转化率,采取的正确措施为
| A.加催化剂同时升高温度 |
| B.加催化剂同时增大压强 |
| C.升高温度同时充入N2 |
| D.降低温度同时增大压强 |
(2)若升高温度,则该反应的平衡常数(填“增大”、“减小”或“不变”).
(3)判断该条件下反应(填能、不能)自发.
在锌与盐酸反应的实验中,一个学生得到的结果如下表所示:
| 锌的质量/g |
锌的形状 |
温度/℃ |
完全溶于溶液的时间/s |
|
| A |
2 |
薄片 |
5 |
400 |
| B |
2 |
薄片 |
15 |
200 |
| C |
2 |
薄片 |
25 |
100 |
| D |
2 |
薄片 |
35 |
t1 |
| E |
2 |
细小颗粒 |
15 |
t2 |
| F |
2 |
粉末 |
15 |
t3 |
| G |
2 |
薄片(含少量杂质Cu) |
35 |
t4 |
(1)t1=s
(2)总结并得出的关于温度影响反应速率的结论是
(3)t1t4(填“>”或“<”),原因是
t2t3(填“>”或“<”),原因是
(4)单位时间内消耗锌的质量mB、mE、mF从大到小的顺序为