(每空2分,共10分)
研究CO2的利用对促进低碳社会的构建具有重要意义。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
已知:Fe2O3(s) + 3C(石墨) =" 2Fe(s)" + 3CO(g) △H 1 =" +489.0" kJ·mol-1
C(石墨) +CO2(g) = 2CO(g) △H 2 =" +172.5" kJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为 。
(2)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:
CO2(g) +3H2(g) CH3OH(g) +H2O(g) △H
CH3OH(g) +H2O(g) △H
①该反应的平衡常数表达式为K= 。
②取一定体积CO2和H2的混合气体(物质的量之比为1∶3),加入恒容密闭容器中,发生上述反应。反应经过相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系如图1所示,则该反应的ΔH 0(填“>”、“<”或“=”)。
③在两种不同温度下发生反应,测得CH3OH的物质的量随时间变化如图2所示,曲线I、Ⅱ对应的平衡常数大小关系为KⅠ KⅡ(填“>”、“<”或“=”)。
④用硫酸溶液作电解质进行电解,CO2在电极上可转化为甲烷,该电极反应的方程式为 。
下图是化学中部分常见的氧化物和单质的转化关系。其中,氧化物f是制造光导纤维的重要原料,氧化物c是一种具有磁性的黑色物质。回答下列问题: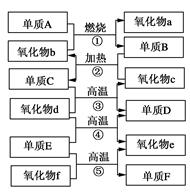
(1)写出下列物质的化学式:单质F________,氧化物d________。
(2)写出下列反应的化学方程式:
①_____________________________________________;
④_____________________________________________。
硫酸和硝酸是中学阶段常见的二种强酸。请就二者与金属铜的反应情况,回答下列问题:
(1)①在100mL 18mol·L-1的浓硫酸中加入过量的铜片,加热使之充分反应,产生的气体在标准状况下的体积可能是。
A.40.32L B.30.24L C.20.16L D.6.72L
②若使上述反应①中剩余的铜片继续溶解,可向其中加入硝酸钠,写出反应的离子方程式。
(2)若将过量铜粉与一定量浓 硝酸反应,当反应完全停止时,共收集到的气体1.12L(标准状况),则该气体的成分是,反应中所消耗的硝酸的物质的量可能为。
硝酸反应,当反应完全停止时,共收集到的气体1.12L(标准状况),则该气体的成分是,反应中所消耗的硝酸的物质的量可能为。
A.0.1mol B.0.15mol C.0.2mol D.0.25mol
农业部防治高致病性禽流感工作新闻发言人2006年3月16日宣布:“广西南宁市和西藏拉萨市疫区已经解除封锁”,这标志着我国高致病性禽流感阻 击战取得了阶段性成果。金刚甲烷、金刚乙胺和达菲已经被批准用于预防人类禽流感。
击战取得了阶段性成果。金刚甲烷、金刚乙胺和达菲已经被批准用于预防人类禽流感。
(1)金刚乙胺,又名α—甲基—1—金刚烷甲基胺,其化学结构简式如下图所示,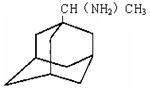
其分子式为_________,金刚乙胺碳原子上的氢原子在一定条件下可被氯原子取代,其一氯取代物有______种。
(2)金刚乙胺是金刚乙烷的衍生物,金刚乙烷有很多衍生物,它们可以相互衍变。下图就是它的部分衍生物相互衍变图。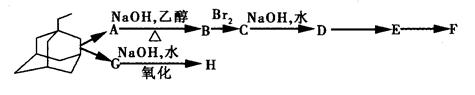
经检测发现,E分子中有两个C=O键,但与新制氢氧化铜反应得不到红色沉淀;
1 mol F与足量的钠完全反应生成22.4 L气体(标准状况下);H具有酸性,且分子式中只比F少1个O。据此回答下列问题(可用“R”表示 ):
):
①A→B.E→F的反应类型分别为_____、____。
②写出D、E、F、H的结构简式:D_、E、F、H_____。
③写出:C→D的化学方程式:_____________;
④F在一定条件下,可发生缩聚反应,形成高分子化合物I,试写出化学方程式: _ ____。
有机化合物D常用于香料工业和电镀工业。D的合成过程如图所示:
已知: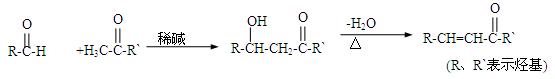
(1)①A中含氧官能团的名称是。
②A可以发生的反应是(填字母)。
a.还原反应 b.消去反应 c.水解反应 d.取代反应
(2)B是由碳、氢、氧三种元素组成的化合物,经质谱分析相对分子质量为58;分子中含有碳氧双键和2个甲基。B的结构简式
(3)D的结构简式是
(4)F可作塑料热稳定剂,由苯酚和B反应制得:
F能与NaOH反应,F分子苯环上的一 氯取代产
氯取代产 物只有两种,核磁共振氢谱显示其分子中含有4种不同类型的氢原子。F的结构简式是
物只有两种,核磁共振氢谱显示其分子中含有4种不同类型的氢原子。F的结构简式是
有机物A与CH3COOH无论以何种比例混合,只要总质量一定,完全燃烧后产生的水的质量也一定,试回答下列问题。
(1)符合条件的相对分子质量最小的有机物A是(写结构简式).
(2)若A与乙酸相对分子质量相等,是农业最常见的氮肥,则A的结构简式是 .
.
(3)若A中C、H元素质量分数之和为86.67%,其余为O,A的分子量小于200,则A 的分子式为。如果A中含苯环结构且能发生银镜反应,符合条件的A的所有同分异构体是