下图所示仪器可用于实验室制备少量无水FeCl3,仪器连接顺序正确的是
| A.a-b-c-d-e-e-f-g-h | B.a-e-d-c-b-h-i-g |
| C.a-d-e-c-b-h-i-g | D.a-c-b-d-e-h-i-f |
有A、B、C、D四种金属,将A与B用导线联结起来,浸入电解质溶液中,B不易被腐蚀;将A、D分别投入到等浓度的盐酸中,D比A反应剧烈;将铜浸入B的盐溶液中无明显变化;将铜浸入C的盐溶液中,有金属C析出。据此可推知它们的金属活动性由强到弱的顺序为 ()
A.D>C>A>BB.D>A>B>C C.D>B>A>C D.B>A>D>C
已知下列热化学方程式:
(1)CH3COOH(l)+2O2(g)==2CO2(g)+2H2O(l) ΔH1=-870.3 kJ·mol-1
(2)C(s)+O2(g)===CO2(g) ΔH2=-393.5 kJ·mol-1
(3)H2(g)+O2(g)===H2O(l)ΔH3=-285.8 kJ·mol-1,
则反应2C(s)+2H2(g)+O2(g)===CH3COOH(l)的焓变ΔH为( )
| A.488.3 kJ·mol-1 | B.-244.15 kJ·mol-1 |
| C.244.15 kJ·mol-1 | D.-488.3 kJ·mol-1 |
一定量的混合气体,在密闭容器中发生如下反应:xA(g) + yB(g)  zC(g),达到平衡后测得A气体的浓度为1mol·L-1,当恒温下将密闭容器的容积扩大到2倍再达到平衡后,测得A的浓度为0.7mol·L-1,则下列叙述正确的是〔〕
zC(g),达到平衡后测得A气体的浓度为1mol·L-1,当恒温下将密闭容器的容积扩大到2倍再达到平衡后,测得A的浓度为0.7mol·L-1,则下列叙述正确的是〔〕
| A.平衡向正反应方向移动 | B.x + y = z |
C.C的体积分数升高 |
D.B的转化率降低 |
反应A(g)+3B(g)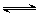 2C(g)△H﹤0达到平衡后,将气体混合
2C(g)△H﹤0达到平衡后,将气体混合 物的温度降低,下列叙述正确的是()
物的温度降低,下列叙述正确的是()
| A.正反应速率增大,逆反应速率变小,平衡向正反应方向移动 |
B.正反应速率变小,逆反应速率增大,平衡向逆反应方向 移动 移动 |
| C.正反应速率和逆反应速率都变小,平衡向正反应方向移动 |
| D.正反应速率和逆反应速率都变小,平衡向逆反应方向移动 |
有一处于平衡状态的反应A(g) + 3B(g)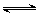 2C(g)△H<0,为了使平衡向生成
2C(g)△H<0,为了使平衡向生成 C的方向移动,应选择的条件是〔〕
C的方向移动,应选择的条件是〔〕
①升高温度②降低温度③ 增大压强④降低压强⑤加入催化剂⑥分离出C
A①③⑤ B②③⑤ C②③⑥D②④⑥