下列实验现象与对应结论均正确的是( )
| 选项 |
操作 |
现象 |
结论 |
| A |
常温下将Cu片放入浓H2SO4中 |
生成刺激性气味气体 |
Cu与浓H2SO4反应生成SO2 |
| B |
Al2(SO4)3溶液中滴加过量氢氧化钡溶液 |
生成白色沉淀 |
Al(OH)3不溶于氢氧化钡溶液 |
| C |
向某溶液中加入KSCN溶液,再向溶液中加入新制氯水 |
溶液先不显红色,加入氯水后变红色 |
该溶液中含有Fe2+ |
| D |
向某溶液中加入CCl4,振荡后静置 |
液体分层,下层呈紫红色 |
该溶液中存在I- |
与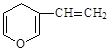 互为同分异构体的芳香族化合物最多有
互为同分异构体的芳香族化合物最多有
| A.3种 | B.4种 | C.5种 | D.6种 |
奥运吉祥物福娃外材为纯羊毛线,内充物为无毒的聚酯纤维(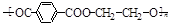 ),下列说法不正确的是
),下列说法不正确的是
| A.可用点燃方法区别羊毛与聚酯纤维 |
| B.聚酯纤维和羊毛一定条件下均能水解 |
| C.该聚酯纤维单体为对苯二甲酸和乙二醇 |
| D.由单体合成聚酯纤维的反应属加聚反应 |
丁腈橡胶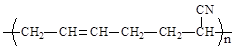 具有优良的耐油耐高温性能,合成
具有优良的耐油耐高温性能,合成
丁腈橡胶的原料是
①CH2=CH-CH=CH2②CH3-C≡C-CH3③CH2=CH-CN
④CH3-CH=CH-CN⑤CH3-CH=CH2⑥CH3-CH=CH-CH3
| A.③⑥ | B.②③ | C.①③ | D.④⑤ |
加拿大阿尔贡天文台在星际空间发现了HC9N链状分子,其结构式为:
HC≡C—C≡C—C≡C—C≡C—C≡N,这是人类迄今发现的最重星际有机分子,有关该分子的说法不正确的是
| A.该物质属于不饱和烃 |
| B.该分子中所有原子处在一条直线上 |
| C.该分子在一定条件下可发生加成反应 |
| D.该分子碳、氮原子均满足八电子结构 |
下列关于有机化合物的说法正确的是
| A.乙酸和乙酸乙酯可用Na2CO3溶液加以区别 |
| B.汽油、乙烯均为石油分馏产品 |
| C.可以用分液的方法分离硝基苯和苯 |
| D.有机化合物都能燃烧 |