1862年,比利时化学家索尔维发明了氨碱法制碱,1926年,我国化学家侯德榜创立了
更为进侯德榜制碱法,也叫联合制碱法,两种制碱的生产流程可简要表示如下图:


氨碱法生产流程 联合制碱法生产流程
(1)向沉淀池中通入CO2和氨气时,应先通入氨气的原因是 。
(2)沉淀池中发生反应的化学反应方程式是 从沉淀池中分离沉淀的操作是 。
(3)氨碱法生产流程示意图中的Y是 ,从原料到产品,氨碱法总反应过程用化学方程式表示,可写为 。
(4)联合制碱法中从滤液中提取氯化铵晶体的过程推测,所得结论正确是 (选填编号)。
a.常温时氯化铵的溶解度比氯化钠小
b.通入氨气能增大NH4+的浓度,使氯化铵更多析出
c.加入食盐细粉能提高Na+的浓度, 使NaHCO3结晶析出
d.通入氨气能使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
(5)联合制碱法相比于氨碱法,氯化钠利用率从70%提高到90%以上,主要是设计了循环Ⅰ,联合制碱法的另一项优点是 。
(6)产品纯碱中含有碳酸氢钠,可以用加热分解的方法测定产品中纯碱的质量分数,已知样品质量为ag,加热至质量不再改变时称重为bg,则纯碱的质量分数为 。
现有A、B、C、D、E五种盐溶液,分别由 、
、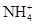 、
、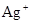 、
、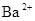 、
、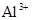 、
、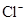 、
、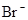 、
、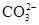 、
、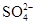 、
、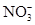 中的阳离子和阴离子各一种组成(五种盐所含阴、阳离子各不相同).已知:①A+B→白↓②A+D→白↓③B+C→白↓+↑④D+C→白↓⑤A溶液中
中的阳离子和阴离子各一种组成(五种盐所含阴、阳离子各不相同).已知:①A+B→白↓②A+D→白↓③B+C→白↓+↑④D+C→白↓⑤A溶液中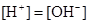 ⑥B溶液中
⑥B溶液中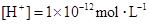 ⑦C、D、E三种溶液的pH<7,根据以上实验事实可以推出(用分子式表示)A为___________________;B为__________________;C为___________________;D为__________________;E为___________________。
⑦C、D、E三种溶液的pH<7,根据以上实验事实可以推出(用分子式表示)A为___________________;B为__________________;C为___________________;D为__________________;E为___________________。
写出④反应的离子方程式:_____________________________________________________
(7分)A、B、C、D、E为原子序数依次增大的同周期主族元素,已知A、C、E三原子的
最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水,D元素原子的最外层电子数比次外层电子数少4,回答:
(1)写出下列元素的符号: B ____,C ____,E ____;
(2)D的常见固态氧化物是 __晶体, 每n mol该氧化物晶体中含D—O键共为 _______mol;
(3) A、C两种元素最高价氧化物的水化物反应的离子方程式:
________________________________________________________________。
某混合溶液中可能含有的离子如下表所示:
| 可能大量含有的阳离子 |
H+、Ag+、Mg2+、Al3+、NH4+、Fe3+ |
| 可能大量含有的阴离子 |
Cl-、Br-、I-、CO32-、AlO2- |
为探究其成分,进行了以下探究实验。
(1)探究一:
甲同学取一定量的混合溶液,向其中逐滴加入氢氧化钠溶液,产生沉淀的物质的量(n)与加入氢氧化钠溶液的体积(V)的关系如右图所示。
①该溶液中一定含有的阳离子是____________,其对应物质的量浓度之比为________,一定不存在的阴离子是_____________;
②请写出沉淀减少过程中发生反应的离子方程式____________________________。
(2)探究二:
乙同学检测到该溶液中含有大量的Cl-、Br-、I-,若向1 L该混合溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如下表所示,分析后回答下列问题:
| Cl2的体积(标准状况) |
5.6 L |
11.2 L |
22.4 L |
| n (Cl-) |
2.5 mol |
3.0 mol |
4.0 mol |
| n (Br-) |
3.0 mol |
2.8 mol |
1.8 mol |
| n (I-) |
x mol |
0 |
0 |
①当通入Cl2的体积为5.6 L时,溶液中发生反应的离子方程式为_______________;
②原溶液中Cl-、Br-、I-的物质的量浓度之比为______________________。
过氧化氢俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。回答下列有关双氧水的一些问题:
(1)下述反应中,H2O2仅体现氧化性的反应是(填代号)_________________。
| A.Na2O2+2HCl=2NaCl+H2O2 | B.Ag2O+H2O2=2Ag+O2↑+H2O |
| C.2H2O2=2H2O+O2↑ | D.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O |
(2)保存过氧化氢的试剂瓶上最适合贴上的一个标签是___________(填字母代号)。
(3)某强酸性反应体系中,反应物和生成物共六种物质或离子:O2、MnO4-、H2O、Mn2+、H2O2、H+。已知该反应中H2O2只发生了如下过程:H2O2→O2↑。
①该反应中发生还原反应的过程是__________________________________。
②如果上述反应中有6.72L(标准状况)气体生成,转移的电子数为_________。
(4)H2O2有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称,如消除采矿业胶液中的氰化物(如KCN),经以下反应实现:KCN+ H2O2+ H2O=A+NH3↑,试指出生成物A的化学式为_______________,并阐明H2O2被称为“绿色氧化剂”的理由是______________________________________________。
分现有反应:mA(g)+nB(g) pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1)该反应的逆反应为_________热反应,m+n_________p(填“>”“=”“<”)。
(2)减压时,A的质量分数_________。(填“增大”“减小”或“不变”,下同)
(3)若加入B(体积不变),则A的转化率_________,B的的转化率_________。
(4)若升高温度,则平衡时B、C的浓度之比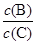 将_________。
将_________。
(5)若加入催化剂,平衡时气体混合物的总物质的量_________。
(6)若B是有色物质,A、C均无色,则加入C(体积不变)时混合物颜色_______;而维持容器内压强不变,充入氖气时,混合物颜色_______(填“变深”“变浅”或“不变”)。