分现有反应:mA(g)+nB(g) pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1)该反应的逆反应为_________热反应,m+n_________p(填“>”“=”“<”)。
(2)减压时,A的质量分数_________。(填“增大”“减小”或“不变”,下同)
(3)若加入B(体积不变),则A的转化率_________,B的的转化率_________。
(4)若升高温度,则平衡时B、C的浓度之比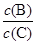 将_________。
将_________。
(5)若加入催化剂,平衡时气体混合物的总物质的量____ _____。
(6)若B是有色物质,A、C均无色,则加入C(体积不变)时混合物颜色______ _;而维持容器内压强不变,充入氖气时,混合物颜色____ ___(填“变深”“变浅”或“不变”)。
海水中提取镁的工业流程如下图所示:
回答下列问题。
⑴用贝壳而不从异地山中开凿石灰石的原因是______________________________。
⑵母液中含有MgCl2,写出反应池1的离子方程式_________________________。
⑶反应池1中,加入Ca(OH)2,使溶液的pH为11时,认为Mg2+沉淀完全[c(Mg2+)<1×10-5mol·L-1],则Mg(OH)2的溶度积约为_______________________。
⑷干燥塔中,在干燥的HCl气流中加热MgCl2·6H2O时,能得到无水MgCl2,其原因是_______________________________________________________________。
⑸电解槽中先得到的是镁的蒸气,镁蒸气可以在下列_____(填编号)气体氛围中冷却。
| A.空气 | B.氧气 | C.水蒸气 | D.氢气 |
⑹镁可用于生产金属钛,主要步骤有:①在高温下,向金红石(主要成分TiO2)与焦炭的混合物中通入Cl2,得到TiCl4和一种可燃性气体;②在稀有气体(如氩)氛围和加热条件下,用镁与TiCl4反应可得到钛。写出上述两步反应的化学方程式。
反应①:____________________________________________________________;
反应②:____________________________________________________________。
A、B、C、D为四种中学化学中常见的单质。常温时A为淡黄色固体,B也是固体且B可被磁化;C和D是双原子分子的气体,C呈黄绿色。E、F、G、H、I为五种化合物,E难溶于水,F为气体,且极易溶于水得无色酸性溶液;H溶于水后得黄色或棕黄色溶液。它们之间有如下反应的转化关系: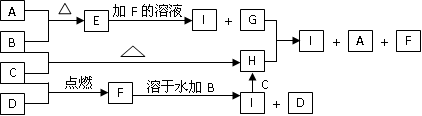
(1)四种物质的化学式:B________,C_______,E________,F_______;
(2)物质I溶液的颜色呈_______色;
(3)用实验方法鉴别H和I可用__________试剂,现象是_________________; (4)写出G+H I+A+F的离子方程式_______________________________。
(4)写出G+H I+A+F的离子方程式_______________________________。
宝石是一种贵重的首饰,石榴子石常用来制造宝石。常见的石榴子石有镁铝石榴子石(Mg3Al2Si3O12)、钙铝石榴子石(Ca3Al2Si3O12)等。请回答:
(1)用氧化物的形式表示钙铝石榴子石(Ca3Al2Si3O12):。
(2)从物质的分类来看,石榴子石属于硅酸盐,下列物质主要成分是硅酸盐的是。
| A.光导纤维 | B.水玻璃 | C.芯片 | D.大理石 |
实验室可以用高锰酸钾和浓盐酸反应制取氯气,反应的化学方程式如下: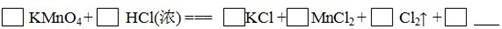
(3)把该化学方程式填写完整
(4)在该反应中,氧化剂是,还原剂是。(写化学式)
今有HCl、C12、H2S、NH3、NO2、CO2、H2、SO2等气体,问:
(1)不能用浓硫酸干燥的是____________________、___________________________
(2)比空气轻的气体是___________、_______________
(3)用水作溶剂,可作喷泉实验的氢化物是________、_______________
(4)能使品红试纸褪色的是_______________、______________。
瑞典化学家舍勒在研究软锰矿(主要成分是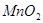 )的过程中,将它与浓盐酸混合加热,产生了一种黄绿色、刺激性气味的气体——氯气。某学生使用这一原理设计如图所示的实验装置,并且利用制得的氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题:
)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色、刺激性气味的气体——氯气。某学生使用这一原理设计如图所示的实验装置,并且利用制得的氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题: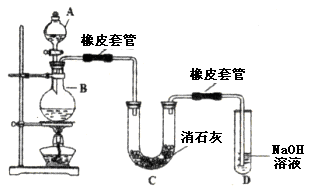
(1)A仪器的名称是__________,所盛试剂是__________,B中发生反应的化学方程式是__________。
(2)漂白粉将在U形管中产生,其化学方程式是____________________。
(3)此实验结果所得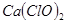 产率太低,经分析并查阅资料发现,主要原因是在U形管中存在两个副反应:
产率太低,经分析并查阅资料发现,主要原因是在U形管中存在两个副反应:
①温度较高时氯气与消石灰反应生成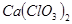 ,为避免此副反应的发生,可采取的措施是______________________________。
,为避免此副反应的发生,可采取的措施是______________________________。
②试判断另一个副反应(写出此反应方程式):____________________。为避免此副反应发生,应采取的措施是______________________________。
(4)漂粉精同盐酸作用产生氯气: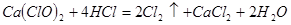 ,该反应中每生成
,该反应中每生成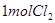 ,转移电子的物质的量为__________
,转移电子的物质的量为__________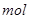 ,被氧化的
,被氧化的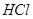 的物质的量为__________
的物质的量为__________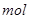 。有效氯是漂粉精中有效
。有效氯是漂粉精中有效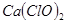 的含量大小的标志。已知:
的含量大小的标志。已知:
有效氯=(漂粉精加盐酸所释放出的氯气的质量/漂粉精的质量) 100%,该漂粉精的有效氯为65%,则该漂粉精中
100%,该漂粉精的有效氯为65%,则该漂粉精中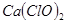 的质量分数为__________(保留一位小数)。
的质量分数为__________(保留一位小数)。