已知:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=-1452 kJ·mol-1
H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1
下列说法正确的是( )
| A.H2(g)的燃烧热为 -571.6 kJ·mol-1 |
| B.同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多 |
C. H2SO4(aq)+ H2SO4(aq)+ Ba(OH)2(aq)= Ba(OH)2(aq)=  BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1 BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1 |
| D.3H2(g)+CO2(g)= CH3OH(l)+H2O(l) ΔH=+135.9 kJ·mol-1 |
下列物质的溶液在蒸发皿加热蒸干、灼烧,可以得到该物质固体的是
A. |
B. |
C.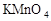 |
D.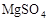 |
下列反应的离子方程式正确的是
| A.向KAl(SO4)2溶液中加入Ba(OH)2至SO完全沉淀: 2Ba2++4OH-+Al3++2SO=2BaSO4↓+AlO+2H2O |
| B.偏铝酸钠溶液中加过量HCl:AlO+4H+=Al3++H2O |
| C.向NH4HSO3溶液中滴入适量NaOH溶液:HSO+OH-=SO+ H2O [ |
| D.电镀铜时阳极反应为:Cu2+ + 2e-= Cu |
25℃,向1LpH = a的NaOH溶液中滴加pH = b的盐酸10L时,刚好完全中和,则(a+b)的值为
| A.13 | B.14 | C.15 | D.12 |
下列有关pH变化的判断中,正确的是
| A.加热盐酸溶液,溶液的pH减小 | B.随温度的升高,纯水的pH增大 |
| C.新制氯水经光照一段时间后,pH减小 | D.NaOH溶液久置于空气中,pH增大 |
常温、常压下饱和CO2溶液的pH为3.9,用已知浓度的盐酸滴定未知浓度的NaHCO3溶液时,应选用的指示剂及滴定终点的颜色变化是
| A.石蕊、由蓝变红 | B.酚酞、红色褪去 |
| C.甲基橙、由橙变黄 | D.甲基橙、由黄变橙 |