在2L密闭容器内,800℃时反应2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间变化如下表:
2NO2(g)体系中,n(NO)随时间变化如下表:
| 时间/s |
0 |
1 |
2 |
3 |
4 |
5 |
| n(NO)/mol |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
(1)写出该反应的平衡常数表达式:K= 。已知:K(300℃)>K(350 ℃),则该反应正反应是 热反应。
(2)图中表示NO2的变化的曲线是 。用O2表示从0~2 s内该反应的平均速率v(O2)= 。
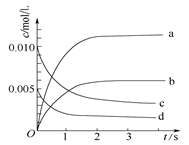
(3)能说明该反应已达到平衡状态的是 。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是 。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
对下列事实的解释错误的是
| A.在蔗糖中加入浓H2SO4后出现发黑现象,是由于浓H2SO4具有吸水性 |
| B.浓H2SO4和木炭能反应,是利用浓H2SO4的强氧化性 |
| C.浓硫酸可以用于干燥Cl2,是利用浓H2SO4的吸水性 |
| D.反应CuSO4+H2S = CuS↓+H2SO4能进行,说明CuS既难溶于水,也难溶于稀硫酸 |
关于硝酸的说法正确的是
| A.浓硝酸见光或受热易分解,必须保存在棕色瓶中 |
| B.浓HNO3是种强氧化剂,但只能使湿润蓝色的石蕊试纸显红色而不褪色 |
| C.稀HNO3和活泼金属反应时主要得到氢气 |
| D.常温下,向浓HNO3中投入Fe片,会产生大量的红棕色气体 |
铜粉放入稀硫酸溶液中,加热后无明显现象发生。当加入一种盐后,铜粉的质量减少,溶液呈蓝色,同时有气体逸出。该盐是
| A.Fe2(SO4)3 | B.Na2CO3 |
| C.KNO3 | D.FeSO4 |
能证明SO2中混有CO2的方法是
| A.通过品红溶液 | B.通过澄清石灰水 |
| C.先通过高锰酸钾溶液,再通过澄清石灰水 | D.先通过澄清石灰水, 再通过高锰酸钾溶液 |
具有相同电子层数,原子序数相连的三种短周期元素X、Y、Z,最高价氧化物对应水化物的酸性相对强弱是:HXO4>H2YO4>H3ZO4,则下列判断正确的是
| A.气态氢化物的稳定性:HX<H2Y<ZH3 | B.非金属活泼性:Y<X<Z |
| C.原子半径:X>Y>Z | D.原子最外层上的电子数关系:Y=" (X+Z)/2" |