随着大气污染的日趋严重,“节能减排”,减少全球温室气体排放,研究NOx、SO2、CO等大气污染气体的处理具体有重要意义。
(1)如图是在101 kPa,298K条件下1mol NO2和1mol CO反应生成1mol CO2和1mol NO过程中的能量变化示意图。
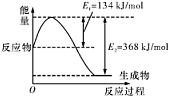
已知:

请写出NO与CO反应生成无污染气体的热化学方
程式: 。
(2)将0.20 mol N02和0.10 mol CO充入一个容积恒定为1L的密闭容器中发生反应,在不同条件下,反应过程中部分物质的浓度变化状况如图所示。

①下列说法正确的是 (填序号)。
a.容器内的压强不发生变化说明该反应达到乎衡
b.当向容器中再充人0. 20 mol NO时,平衡向正反应方向移动,K增大
c.升高温度后,K减小,N02的转化率减小
d.向该容器内充人He气,反应物的体积减小,浓度增大,所以反应速率增大
②计算产物NO在0~2 min内平均反应速率v(NO)= mol·L-1·min-1
③第4 min时改变的反应条件为 (填“升温’’、“降温’’)。
④计算反应在第6 min时的平衡常数K= 。若保持温度不变,此时再向容器中充人CO、NO各0.060 mol,平衡将 移动(填“正向”、“逆向”或“不”)。
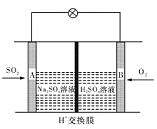
(3)有学者想以如图所示装置用原电池原理将SO2转化为重要的化工原料。其负极反应式为 ,当有0.25 mol SO2被吸收,则通过质子(H+)交换膜的H+的物质的量为 mol。
下列几组物质:
| A.金属石和石墨 | B.C2H6和C5H12 | C.C2H4和C2H6 |
| D.CH3CH2CH2CH3 E.35Cl和37Cl |
(1)属于同分异构体的是___________(填序号,下同);(2)属于同素异形体的是____________;
(3)属于同素物的是___________;(4)属于同位素的是________________。
在NaCl、NH4Cl、N2、CO2中,只含有离子键的是________(填化学式,下同),只含有极性键的是_________,只含有非极性键的是__________,既含有离子键又含有共价键的是__________。
在①6Li ②14N ③7Li ④14C几种核素中:
(1)________和________(填序号,下同)互为同位素。
(2)________和________的质量数相等,但不能互称同位素。
已知:①A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平,A对氢气的相对密度为14;②2CH3CHO+O2 2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线
2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线 如下图所示。
如下图所示。
回答下列问题:
(1)A的相对分子质量为: ;结构简式为: 。
(2)B、D分子中的官能团名称分别是 、 。
(3)写出下列反应的反应类型:
① ,④ 。
(4)写出下列反应的化学方程式:
① ;
④ 。[来
下表为元素周期表的一部分,请回答有关问题:
| IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
|
| 2 |
① |
② |
|||||
| 3 |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
(1)④和⑦的元素符号是和;
(2)表中8种元素中,金属性最强的元素的元素符号是,非金属性最强的元素的元素符号是。
(3)表中能形成两性氢氧化物的元素名称是,写出该元素的氢氧化物与③的最高价氧化物对应水化物反应的离子反应方程式:。