甲醇是重要的化学工业基础原料和液体燃料。工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
| 化学反应 |
平衡常数 |
温度(℃) |
|
| 500 |
800 |
||
①2H2(g)+CO(g)  CH3OH(g) CH3OH(g) |
K1 |
2.5 |
0.15 |
②H2(g)+CO2(g)  H2O (g)+CO(g) H2O (g)+CO(g) |
K2 |
1.0 |
2.50 |
③3H2(g)+ CO2(g)  CH3OH(g)+H2O (g) CH3OH(g)+H2O (g) |
K3 |
|
|
(1)反应②是 (填“吸热”或“放热”)反应。
(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系如图所示。则平衡状态由A变到B时,平衡常数K(A) K(B)(填“>”、“<”或“=”)。
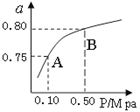
(3)判断反应③△H 0; △S 0(填“>”“=”或“<”)据反应①与②可推导出K1、K2与K3之间的关系,则K3= (用K1、K2表示)。在500℃、2L的密闭容器中,进行反应③,测得某时刻H2、CO2、 CH3OH、H2O的物质的量分别为6mol、2 mol、10 mol、10 mol,此时v(正) v(逆)(填“>”“=”或“<”)
(4)一定温度下,在3 L容积可变的密闭容器中发生反应②,已知c(CO)与反应时间t变化曲线Ⅰ如图所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ。
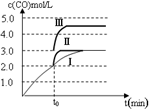
当曲线Ⅰ变为曲线Ⅱ时,改变的条件是 。
当曲线Ⅰ变为曲线Ⅲ时,改变的条件是 。
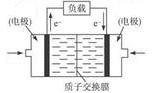
(5)甲醇燃料电池通常采用铂电极,其工作原理如图所示,负极的电极反应为: 。
(6)一定条件下甲醇与一氧化碳反应可以合成乙酸。通常状况下,将0.2 mol/L的醋酸与0.1 mol/LBa(OH)2溶液等体积混合,则混合溶液中离子浓度由大到小的顺序为 。
碱式碳酸钴[Cox(OH)y(C03)z]常用作电子材料、磁性材料的添加剂,受热时可分解生成三种氧化物。为了确定其组成,某化学兴趣小组同学设计了如图所示的装置进行实验。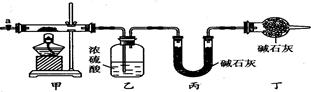
(1)请完成下列实验步骤:
①称取3.65 g样品置于硬质玻璃管内,称量乙、丙装置的质量;
②按如图所示装置组装好仪器,并.
③加热甲中玻璃管,当乙装置中(填实验现象),停止加热;
④打开活塞a,缓缓通入空气数分钟后,称量乙、丙装置的质量;
⑤计算。
(2)步骤④中缓缓通入空气数分钟的目的是o
(3)某同学认为上述实验装置中存在一个明显缺陷,为解决这一问题,可选用下列装置中的(填字母)连接在(填装置连接位置)。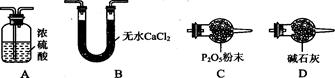
(4)若按正确装置进行实验,测得如下数据。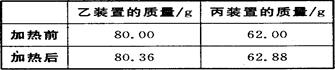
则该碱式碳酸钴的化学式为。
(5)含有Co(A102)2的玻璃常用作实验室观察钾元素的焰色反应,该玻璃的颜色为。
(6)CoCl2·6H2O常用作多彩水泥的添加剂。以含钴废料(含少量Fe、Al等杂质)制取CoCl2·6H2O的一种工艺如下: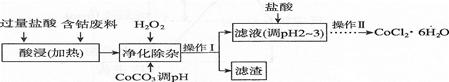
已知:25℃时,Ksp[Fe(OH)3]=2.79X10-39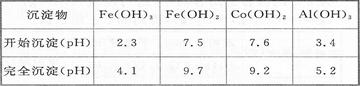
①净化除杂时,加入H2O2发生反应的离子方程式为
②加入CoCO3调pH为5.2~7.6,则操作I获得的滤渣成分为 。
③已知:Fe(OH)3(s)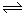 Fe3+(aq)+3OH-(aq)ΔH=akJ/mol
Fe3+(aq)+3OH-(aq)ΔH=akJ/mol
H2O(l)=H+(aq)+OH-(aq)ΔH="b" kJ/mol
请写出Fe3+发生水解反应的热化学方程式:.
水解平衡常数Kh=.
④加盐酸调整pH为2~3的目的为。
⑤操作Ⅱ过程为蒸发浓缩、(填操作名称)、过滤。
(7)某锂离子电池正极是LiCoO2,含Li+导电固体为电解质。充电时,Li+还原为Li,并以原子形式嵌入电池负极材料C6中(如图所示)。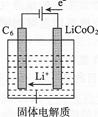
电池反应为LiCoO2+C6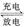 CoO2+LiC6,写出该电池放电时的正极反应式:。
CoO2+LiC6,写出该电池放电时的正极反应式:。
(14分)普通钢中加入少量的钒(V))能极大地改善钢的弹性和强度,使钢材既耐高温又抗奇寒,因此它有“合金维生素”之称。'T业上回收废钒催化剂(含有V2O5、VOSO4、K2SO4、SiO2) 中钒的主要流程如下:
回答下列问题:
(1)滤渣l的主要成分是。
(2)步骤②中发生反应的离子方程式为。
(3)步骤③的变化过程可简化为(HA表示有机萃取剂):VOSO4 (水层)十2HAc(有机层) VOA2(有机层) 十H2SO4 (水层),则步骤④中可选择硫酸作萃取剂的原因是。萃取和反萃取在实验室里用到的玻璃仪器有和。
VOA2(有机层) 十H2SO4 (水层),则步骤④中可选择硫酸作萃取剂的原因是。萃取和反萃取在实验室里用到的玻璃仪器有和。
(4)该工艺流程中,可以循环利用的物质除了氨气以外,还有 。
(5)调节溶液pH,可将(VO2)SO4转变成NH4VO3沉淀。25℃时,当pH 为1. 7~1. 8 时,钒沉淀率为98. 8%,假设其它各步反应都完全进行,已知KC1O3的还原产物是KCl,若每消耗1 mol KC1O3,理论上可回收金属钒g(计算结果保留一位小数)。
(16分)聚乙酸乙烯酪广泛用于制备涂料、粘合剂等,它和高聚物长的合成路线如下: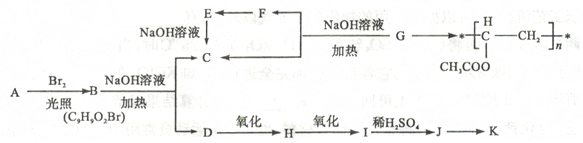
其中J物质与氯化铁溶液能发生显色反应,且苯环上的一元取代物原有两种。
已知①当羟基与双键碳原子相连时,易发生如下转化RCH =CHOH→RCH2CHO
②一ONa连在烃基生不会被氧化
请回答下列问题:CH3COO CH3CH2Br
(1)写出G的结构简式。F与H中具有相同官能团的名称。
(2)上述变化中G→C+F 的反应类型是;J在一定条件下能生成高聚物K,K的结构简式是。
(3)写出B→C+D反应的化学方程式:。
(4)同时符合下列要求的A的同分异构体有种。
I含有苯环
II能发生银镜反应和水解反应
并写出满足下列条件的同分异构体结构简式:。
①核磁共振氢谱有5 个吸收峰
②1mol该同分异构体能与Imol NaOH 反应
(5)下列有关说法正确的是。
a.1 mol A 完全燃烧消耗10.5 mol O2
b.J与足量的碳酸氢钠溶液反应能生成相应的二钠盐
c.D→H 的试剂通常是KMO4酸性溶液
d.J能发生加成、消去、取代、氧化等反应
(14分)X、Y、及W是短周期中的四种元素,其原子序数依次增大。相关信息如下表
| 元素 |
相关信息 |
| X |
具有多种同素异形体,形成的化合物种类繁多 |
| Y |
短周期主族元素中原子半径最大 |
| Z |
位于元素周期表金属与非金属元素的分界线上,最高化合价为十4 |
| W |
富集在海水中的元素,它的某些化合物常用作消毒刹 |
(1)Z元素基态原子的核外电子排布式为,其未成对的电子数目为。
(2)Y位于元素周期表中第周期,第族,四种元素的电负性由大到水的顺序是(写元素符号)。
(3)氢化物中X-H和W-H的化学键极性较强的是,耐磨材料(XY)和单质y 熔点较高的
是(均用元素符号表示)。
(4)已知400 ℃时,HW 可被氧气催化氧化生成W 的单质,从而实现化更生产上W的循环利用。若断开1mo1H一W化学键,该反应放热28.9KJ,试写出相应的热化学方程式:。
在下图所示装置中,U形管内装满稀H2SO4,a为铁电极,b为多孔石墨电极。
(1)断开K2接通K1时,a为_________极,b电极上的电极反应式为___________________
(2)断开K1接通K2时,a为__________极,该电极上的电极反应式为____________________,一段时间后,溶液的pH_________________(填“增大”,“减小”或“不变”)