碘在科研与生活中有重要作用,某兴趣小组用0.50 mol·L—1KI、0.2%淀粉溶液、0.20 mol·L—1K2S2O8、0.10 mol·L—1Na2S2O3等试剂,探究反应条件对化学反应速率的影响。
已知:S2O82—+ 2I— =" 2" SO42— + I2(慢) I2 + 2 S2O32— = 2I— + S4O62—(快)
(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的 耗尽后,溶液颜色将由无色变为蓝色,为确保能观察到蓝色,S2O32—与S2O82—初始的物质的量需满足的关系为:n(S2O32—):n(S2O82—) 。
(2)为探究反应物浓度对化学反应速率的影响,设计的实验方案如下表:
| 实验 序号 |
体积V/ml |
||||
| K2S2O8溶液 |
水 |
KI溶液 |
Na2S2O3溶液 |
淀粉溶液 |
|
| ① |
10.0 |
0.0 |
4.0 |
4.0 |
2.0 |
| ② |
9.0 |
1.0 |
4.0 |
4.0 |
2.0 |
| ③ |
8.0 |
Vx |
4.0 |
4.0 |
2.0 |
表中Vx = ml,理由是 。
(3)已知某条件下,浓度c(S2O82—)~反应时间t的变化曲线如图13,若保持其它条件不变,请在答题卡坐标图中,分别画出降低反应温度和加入催化剂时c(S2O82—)~反应时间t的变化曲线示意图(进行相应的标注)。

(4)碘也可用作心脏起捕器电源—锂碘电池的材料,该电池反应为:
2 Li(s) + I2 (s) =" 2" LiI(s) ΔH
已知:4 Li(s) + O2 (g) =" 2" Li2O(s) ΔH1
4 LiI(s) + O2 (g) =" 2" I2 (s) + 2 Li2O(s) ΔH2
则电池反应的ΔH = ;碘电极作为该电池的 极。
已知合成氨的反应为3H2(g)+N2(g) 2NH3(g)△H<0,在某密闭容器中测得实验数据及数据处理如下表。
2NH3(g)△H<0,在某密闭容器中测得实验数据及数据处理如下表。
(1)下列说法可以说明合成氨反应达到平衡的是
A.恒容时,整个容器内密度不变
B.恒压时,容器内平均相对分子质量不变
C.1 mol N≡N键断裂的同时,有3mol H-H键断裂
(2)当升高温度时,平衡向方向移动(填“正”或“逆”),请画出在t2时刻升温后的v-t图,并作出必要的标注。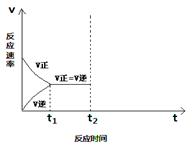
(3)表中实验2的K2=,温度T1、T2的大小关系是,你判断的理由是。
合成喹啉及其衍生物常用的方法是Skraup合成法,以下是用苯胺、甘油、浓硫酸和硝基苯共热制备喹啉的反应流程。
(1)上图中A的名称为,C的分子式为
(2)II的反应类型为
(3)下列关于化合物C的说法,正确的是
| A.1mol化合物C最多能与3mol氢气反应 |
| B.可发生银镜反应 |
| C.能使酸性高锰酸钾溶液褪色 |
| D.属于芳香烃 |
(4)①化合物E和F也能发生类似II的反应,请写出生成物的结构简式。
②化合物F有多种同分异构体,其中属于醛类的有(不包括该物质本身)(写结构简式)
(16分)碳、氮、硫、氯是四种重要的非金属元素。
(1)CH4(g)在O2(g)中燃烧生成CO(g)和H2O(g)的△H难以直接测量,原因是
(2)工业上合成氨气的反应为:N2(g) + 3H2(g)  2NH3(g)△H<0。现将10 mol N2和26 mol H2置于容积可变的密闭容器中,N2的平衡转化率(
2NH3(g)△H<0。现将10 mol N2和26 mol H2置于容积可变的密闭容器中,N2的平衡转化率( )与体系总压强(P)、温度(T)的关系如图所示。
)与体系总压强(P)、温度(T)的关系如图所示。
回答下列问题:
①反应达到平衡状态B时,容器的容积10 L,则T1时,合成氨反应的平衡常数K= 。
②平衡状态由A变到C时,对应的平衡常数K(A)K(C)(填“>”、“<”或“=”)。
③平衡状态由A变到B时,对应的平衡常数K(A)K(B)(填“>”、“<”或“=”)。
(3)在25℃时,HSCN、HClO、H2CO3的电离常数如下表:
| HClO |
HSCN |
H2CO3 |
| K=3.2×10-8 |
K=0.13 |
Kl=4.2×10-7 K2=5.6×10-11 |
①1 mol·L-1的KSCN溶液中,所有离子的浓度由大到小的顺序为
②向Na2CO3溶液中加入过量HClO溶液,反应的化学方程式为
③同浓度的A.NaClO B. Na2CO3 C. NaSCN 比较各溶液pH由大到小的是(用A.B.C回答)
(16分)对金属制品进行抗腐蚀处理,可延长其使用寿命。
(1)以下为铝材表面处理的一种方法:
①碱洗的目的是除去铝材表面的自然氧化膜,碱洗时候常有气泡冒出,原因是(用离子方程式表示)。为将碱洗槽液中的铝以沉淀形式回收,最好向槽液中加入下列试剂中的。
a.NH3 b.CO2 c.NaOH d.HNO3
②以铝材为阳极,在H2SO4溶液中电解,电解后取少量废电解液,加入NaHCO3,溶液后产生气泡和白色沉淀,产生沉淀的原因是(用离子方程式表示)
(2)镀铜可防止铁制品腐蚀,电镀时用来做阳极。
(3)利用如图装置,可以模拟铁的电化学防护。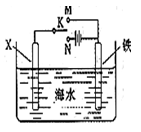
若X为碳棒,为减缓铁的腐蚀,开关K应放于处,写出X极的电极反应
若X为碳棒,开关K置于M处,写出X极的电极反应
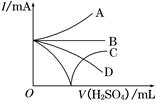
(7分)向Ba(OH)2溶液中逐滴加入稀硫酸.请完成下列问题:
(1)写出反应的离子方程式__________________________________________;
(2)下列三种情况下,离子方程式与(1)相同的是________(填序号)。
A.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至溶液显中性
B.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至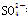 恰好完全沉淀
恰好完全沉淀
C.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至过量
(3)若缓缓加入稀H2SO4直至过量,整个过程中混合溶液中的导电能力(用电流强度I表示)可近似地用右图中的曲线表示是________(填序号).