Ⅰ.在一定条件下,科学家利用从烟道气中分离出CO2与太阳能电池电解水产生的H2合成甲醇,其过程如下图所示,试回答下列问题:
(1)该合成路线对于环境保护的价值在于 。
(2)15~20%的乙醇胺(HOCH2CH2NH2)水溶液具有弱碱性,上述合成线路中用作CO2吸收剂。用离子方程式表示乙醇胺水溶液呈弱碱性的原因 。
(3)CH3OH、H2的燃烧热分别为:△H=-725.5 kJ/mol、△H=-285.8 kJ/mol,写出工业上以CO2、H2合成CH3OH的热化学方程式: 。
Ⅱ.将燃煤废气中的CO2转化为甲醚的反应原理为:
2CO2(g) + 6H2(g)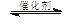 CH3OCH3(g) + 3H2O(g)
CH3OCH3(g) + 3H2O(g)
已知一定压强下,该反应在不同温度、不同投料比时,CO2的转化率见下表:
| 投料比[n(H2) / n(CO2)] |
500 K |
600 K |
700 K |
800 K |
| 1.5 |
45% |
33% |
20% |
12% |
| 2.0 |
60% |
43% |
28% |
15% |
| 3.0 |
83% |
62% |
37% |
22% |
(4)该反应的焓变△H 0,熵变△S 0(填>、<或=)。
(5)用甲醚作为燃料电池原料,在碱性介质中该电池负极的电极反应式 。
(6)若以1.12 L·min-1(标准状况)的速率向该电池中通入甲醚(沸点为-24.9 ℃),用该电池电解500 mL 2 mol·L-1 CuSO4溶液,通电0.50 min后,理论上可析出金属铜 g。
铅蓄电池是典型的可充型电池,它的正负极格板是惰性材料,电池总反应式为:
Pb+PbO2+4H++2SO42- 2PbSO4+2H2O请回答下列问题
2PbSO4+2H2O请回答下列问题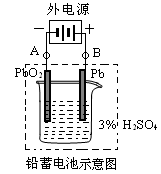
(1)放电时:正极的电极反应式是________________;电解液中H2SO4的浓度将变________;当外电路通过1 mol电子时,理论上负极板的质量减少________g。
(2)在完全放电耗尽PbO2和Pb时,若按图连接,电解一段时间后,则在A电极上生成________,此时铅蓄电池的正负极的极性与原来______。(“相同”或“不同”)(每空2分)
已知25 ℃时0.1 mol·L-1醋酸溶液的pH约为3,向其中加入少量醋酸钠晶体,待晶体溶解后发现溶液的pH增大。对上述现象有两种不同的解释:甲同学认为醋酸钠水解呈碱性,增大了c(OH-),因而溶液的pH增大;乙同学认为醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使c(H+)减小,因此溶液的pH增大。
(1)为了验证上述哪种解释正确,继续做如下实验,向0.1 mol·L-1的醋酸溶液中加入少量下列物质中的__________(填写编号),然后测定溶液的pH。
| A.固体CH3COOK | B.固体CH3COONH4 |
| C.气体NH3 | D.固体NaHCO3 |
(2)若________(填“甲”或“乙”)的解释正确,溶液的pH应________(填“增大”减小”或“不变”)。(已知:25 ℃时,NH3·H2O的Ka=1.8×10-5,CH3COOH的Kb=1.8×10-5)
(1)将等质量的Zn粉分别投入:试管A: 10mL 0.1mol·L-1 HCl和试管B: 10mL 0.1mol·L-1醋酸中: 开始时,反应速率AB(填>,=或<,下同),若Zn过量,产生H2的体积AB。
(2)将等质量Zn粉分别投入pH=1体积均为10mL的试管A: 盐酸和试管B: 醋酸中: 开始时,反应速率AB(填>,=或<,下同),若Zn过量,产生H2的体积AB。
根据所学知识,完成下列要求。
(1)0.2 mol OH-的质量为,其中含有个电子;标况下L HCl气体溶于水可配成12 mol/L HCl溶液500 mL。
(2)我国是最早使用铜及其合金的国家之一,我国古代劳动人民更最早利用天然铜的化合物进行湿法炼铜,这是湿法技术的起源,是世界化学史上的一项发明。西汉《淮南子·万毕术》记载:曾青得铁则化为铜,曾青为硫酸铜。
在该反应中被氧化的元素是,氧化剂是;该反应的离子方程式为:。
(3)就有关物质的分离回答下面的问题。
①现有一瓶A和B的混合液,已知它们的性质如下表。
| 物质 |
熔点/℃ |
沸点/℃ |
密度/g·cm-3 |
溶解性 |
| A |
-11.5 |
198 |
1.11 |
A、B互溶,且均易溶于水 |
| B |
17.9 |
290 |
1.26 |
据此分析,将A和B相互分离的常用方法是。
②在分液漏斗中用一种有机溶剂萃取水溶液里的某物质时,静置分层后,如果不知道哪一层液体是“水层”,试设计一种简便的判断方法。
答:。
根据所学知识,完成下列要求。
(1)Fe2(SO4)3(写出电离方程式):。
(2)H++OH-═ H2O(写出对应的化学方程式):。
(3)氧化铜溶于盐酸(写出对应的离子反应方程式):。
(4)锌与稀硫酸反应制取氢气(写出对应的离子反应方程式):。