下列说法正确的是
| A.常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4 |
| B.为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH。若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 |
| C.用0.2000 mol/L NaOH标准溶液滴定HCl与CH3COOH的混合溶液(混合液中两种酸的浓度均约为0.1 mol/L),至中性时,溶液中的酸未被完全中和 |
| D.相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1mol/L盐酸、③0.1 mol/L氯化镁溶液、④0.1mol/L硝酸银溶液中,Ag+浓度:①>④=②>③ |
A、B、C、D、E为短周期元素组成的中学常见物质,它们转化关系如图所示(部分产物、条件略去)。
下列说法正确的是()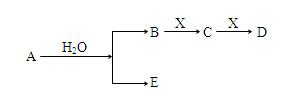
A.若C为二氧化碳,则E可以是强碱也可以是强酸
B.若D为白色胶状难溶物,且与A摩尔质量相等,则E为一常见气体单质
C.若E为氢气,则A一定为金属单质钠
D.若A为金属单质,则X一定为二氧化碳
由一种阳离子和两种酸根离子组成的盐称混盐。下列关于混盐Na4S2O3的有关判 断,不正确的是()
断,不正确的是()
| A.该混盐水溶液呈碱性 |
| B.该混盐溶液加入BaCl2可以生成白色沉淀 |
| C.该混盐与H2SO4反应有气体生成 |
| D.该混盐在酸性条件下可生成S,每产生1molS转移2NA个电子 |
下列反应与有机物官能团性质无关的是()
| A.工业上利用油脂合成肥皂 | B.苯乙烯使酸性高锰酸钾溶液褪色 |
| C.用甲苯和浓硝酸制取TNT炸药 | D.钠放入无水乙醇中放出氢气 |
中学化学教材中有大量数据,下列是某同学对数据的利用情况,其中正确的是()
| A.利用溶液的PH与7的大小,来判断溶液的酸碱性 |
| B.利用熔沸点数据推测两种金属形成合金的可能性 |
| C.利用反应热数据大小判断不同反应的反应速率大小 |
| D.利用熵变的数据判断反应是否能自发进行 |
常温下,下列溶液的pH或微粒的物质的量浓度关系正确的是
A.某物质的溶液中由水电离出的c(H+)=1×10-a mol/L,若a>7时,则该溶液的pH一定为14-a
B.某溶液中存在的离子有S2-、HS-、OH-、Na+、H+,则离子浓度一定是
c(Na+) >c(S2-)>c(OH-) >c(HS-) >c(H+)
C.pH=3 的二元弱酸H2R溶液与 pH=11的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液:c(R2-)+ c(HR-)=c(Na+)
的二元弱酸H2R溶液与 pH=11的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液:c(R2-)+ c(HR-)=c(Na+)
D.将0.2 mol/L的某一元酸HA溶液和0.1mol/L NaOH溶液等体积混合后溶液pH大于7,则反应后的混合液:2c(OH-)=2c(H+)+c(HA)-c(A-)