(2014届江苏省高三百校联合调研测试(一)化学试卷)
二氧化氯(ClO2)可用于自来水消毒。以粗盐为原料生产ClO2的工艺主要包括:①粗盐精制;②电解微酸性NaCl溶液;③ClO2的制取。工艺流程如下图:

(1)粗食盐水中含有Ca2+、Mg2+、SO42-等杂质。除杂操作时,往粗盐水中先加入过量的试剂X,X是 (填化学式),至沉淀不再产生后,再加入过量的Na2CO3和NaOH,充分反应后将沉淀一并滤去。经检测发现滤液中仍含有一定量的SO42-,其原因是 。(已知:Ksp(BaSO4)=1.1×10-10;Ksp(BaCO3)=5.1×10-9)
(2)上述过程中,将食盐水在特定条件下电解得到的氯酸钠与盐酸反应生成ClO2。电解时生成的气体B是 ;反应Ⅲ的化学方程式为 。
(3)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了以下实验:
步骤1:准确量取ClO2溶液10.00 mL,稀释成100 mL试样。
步骤2:量取V1mL试样加入到锥形瓶中,调节试样的pH≤2.0,加入足量的KI晶体,摇匀,在暗处静置30分钟。(已知:ClO2+I-+H+—I2+Cl-+H2O 未配平)
步骤3:以淀粉溶液作指示剂,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。(已知:I2+2S2O32-=2I-+S4O62-)
① 准确量取10.00 mL ClO2溶液的玻璃仪器是 。
② 滴定过程中,至少须平行测定两次的原因是 。
③ 根据上述步骤可计算出原ClO2溶液的物质的量浓度为 mol·L-1(用含字母的代数式表示)。
工业上用活性炭吸附海带提碘后废水中的I-制取I2,其流程如下图: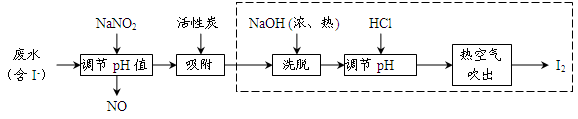
(1)向废水中加入NaNO2并调节pH<4,写出反应的离子方程式__________________。
(2)用活性炭吸附生成的单质碘的目的是__________________________,用浓、热NaOH洗脱吸附的碘的化学方程式为___________________________________。
(3)从调节pH后所得的溶液中获取碘,工业上可用热空气吹出,其原因是___________;若取少量该溶液在实验室中分离得到单质碘,需要进行的操作为__________________。
(4)流程中生成的NO尾气有毒,工业上将其与O2按一定比例通入NaOH制备NaNO2,写出反应的化学方程式:________________________________。
(5)工业上虚框内流程还可用如图操作代替,评价下图流程的优点___________________________(写出一条)。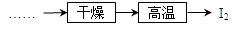
为了测定实验室长期存放的Na2SO3固体的纯度,准确称取W g固体样品,配成250 mL溶液。设计了以下两种实验方案:
方案I:取25.00 mL上述溶液,加入过量的盐酸酸化的BaCl2溶液,过滤、洗涤和干燥沉淀,称得沉淀的质量为m1 g 。
方案Ⅱ:取25.00 mL上述溶液,加入过量的盐酸酸化的Ba(NO3)2溶液,过滤、洗涤和干燥沉淀,称重,其质量为m2 g 。
(1)配制250 mL Na2SO3溶液时,必须用到的实验仪器有:烧杯、玻棒、胶头滴管、药匙和__________________、_________________。
(2)写出Na2SO3固体氧化变质的化学方程式__________________________________。
(3)方案I加入过量的盐酸酸化的BaCl2溶液,目的是_____________________________,在过滤前,需要检验是否沉淀完全,其操作是___________________________。
(4)方案I中,若滤液浑浊,将导致测定结果____________(选填“偏高”或“偏低”)。
(5)若操作正确,则m1_____ m2(选填“>”、“<”或“=”),原因是________________。
(6)取25.00 mL上述溶液,用滴定的方法测定Na2SO3的纯度。下列试剂可作为标准溶液进行滴定的是________。
a.酸性KMnO4溶液 b.H2O2溶液 c.Br2水 d.FeCl3溶液
Na2SO3固体的纯度可表示为:(注明你的表达式中所用的有关符号的含义和单位)。
下图是实验室制备1,2—二溴乙烷并进行一系列相关实验的装置(加热及夹持设备已略)。
有关数据列表如下:
| 乙醇 |
1,2-二溴乙烷 |
乙醚 |
|
| 状态 |
无色液体 |
无色液体 |
无色液体 |
| 密度/g/cm3 |
0.79 |
2.2 |
0.71 |
| 沸点/℃ |
78.5 |
132 |
34.6 |
| 熔点/℃ |
一l30 |
9 |
-1l6 |
请按要求回答下列问题:
(1)A中药品为1:3的无水乙醇和浓硫酸混合液,写出制备乙烯的化学反应方程式:____________________________________________________________。
(2)气体发生装置使用连通滴液漏斗的原因_________________________________________。
(3)装置D中品红溶液的作用是_______________;同时B装置是安全瓶,监测实验进行时E中是否发生堵塞,请写出堵塞时的现象_______________________________________。
(4)反应过程中应用冷水冷却装置E,其主要目的是___________________________;但又不能过度冷却(如用冰水),其原因是_____________________________________________。
(5)判断该制备反应已经结束的方法是__________________;结果学生发现反应结束时,无水乙醇消耗量大大超过理论值,其原因是_______________________________________。
(6)有学生提出,装置F中可改用足量的四氯化碳液体吸收多余的气体,判断改用四氯化碳液体是否可行______(填“是”或“否”),其原因是____________________________。
某化学研究性学习小组设计实验探究铜的常见化学性质,过程设计如下。
提出猜想
问题1:在周期表中,铜与铝的位置很接近,铜不如铝活泼,氢氧化铝具有两性,氢氧化铜也有两性吗?
问题2:铁和铜都有变价,一般情况下,正二价铁的稳定性小于正三价的铁,正一价铜的稳定性也小于正二价的铜吗?
问题3:氧化铜有氧化性,能被H2、CO还原,它也能被氮的某种气态氢化物还原吗?
实验探究
Ⅰ. 解决问题1
(1)需用到的药品除1 mol·L-1CuSO4溶液、稀硫酸外还需(填试剂的化学式)溶液。
(2)用胆矾晶体配制1 mol·L-1CuSO4溶液250 mL,选用的仪器除烧杯、托盘天平、药匙、玻璃棒、胶头滴管外,还有(填仪器名称)。
(3)为达到实验目的,你认为应进行哪些相关实验?
实验内容和步骤:①;②。
Ⅱ. 解决问题2
取一定量制得的氢氧化铜固体,于坩埚中灼烧,当温度达到80~100℃得到黑色固体粉末;继续加热至1000℃以上,黑色粉末全部变成红色粉末氧化亚铜;取适量红色氧化亚铜粉末于洁净试管中,加入过量的稀硫酸(或盐酸),得到蓝色溶液,同时观察到试管底部还有红色固体存在。根据以上实验现象回答问题。
(1)写出氧化亚铜与稀硫酸(或盐酸)反应的离子方程式:,
(2)从实验Ⅱ可得出的结论是。
Ⅲ. 解决问题3
设计如下装置(夹持装置未画出):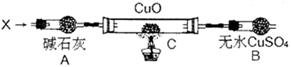
当氮的某种气态氢化物(X)缓缓通过灼热的氧化铜时,观察到氧化铜由黑色变成了红色,无水硫酸铜变成蓝色,生成物中还有一种无污染的气体Y;将X通入灼热的CuO燃烧管完全反应后,消耗0.01 mol X,测得B装置增重0.36 g,并收集到0.28 g单质气体Y。
(1)X气体的摩尔质量是。
(2)C中发生反应的化学方程式为。
醇脱水是合成烯烃的常用方法,实验室合成己烯的反应和实验装置如下: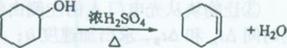
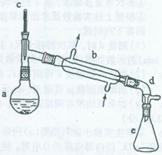
可能用到的有关数据如下:
| 相对分子质量 |
密度/(g·cm-3) |
沸点/℃ |
溶解性 |
|
| 环己醇 |
100 |
0.9618 |
161 |
微溶于水 |
| 环己烯 |
82 |
0.8102 |
83 |
难溶于水 |
合成反应:
在a中加入20 g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1 mL浓硫酸。b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃。
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙。最终通过蒸馏得到纯净环己烯l0 g。
回答下列问题:
(1)装置b的名称是______。
(2)加入碎瓷片的作用是_______________________;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是(填正确答案标号)。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)本实验中最容易产生的副产物的结构简式为__________。
(4)分液漏斗在使用前须清洗干净并__________;在本实验分离过程中,产物应该从分液漏斗的______(填“上口倒出”或“下口放出”)。
(5)分离提纯过程中加入无水氯化钙的目的是_________________________。
(6)在环己烯粗产物蒸馏过程中,不可能用到的仪器有__________(填正确答案标号)。
A.蒸馏烧瓶 B.温度计 C.玻璃棒 D.冷凝管
(7)本实验所得到的环已烯产率是__________(填正确答案标号)。
A.41% B.50% C.61% D.70%