苯甲酸广泛应用于制药和化工行业,某同学尝试用甲苯的氧化反应制备苯甲酸,反应原理:
实验方法:一定量的甲苯和KMnO4溶液在100℃反应一段时间后停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯。
已知:苯甲酸分子量122,熔点122.4℃,在25℃和95℃时溶解度分别为0.3 g和6.9 g;纯净固体有机物都有固定熔点。
(1)操作Ⅰ为 ,操作Ⅱ为 。
(2)无色液体A是 ,定性检验A的试剂是 ,现象是
。
(3)测定白色固体B的熔点,发现其在115℃开始熔化,达到130℃时仍有少量不熔,该同学推测白色固体B是苯甲酸与KCl的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确。请在答题卡上完成表中内容。
| 序号 |
实验方案 |
实验现象 |
结论 |
| |
将白色固体B加入水中,加热溶 解, |
得到白色晶体和无色溶液 |
----------------- |
| ② |
取少量滤液于试管中, |
生成白色沉淀 |
滤液含Cl— |
| ③ |
干燥白色晶体, |
|
白色晶体是苯甲酸 |
(4)纯度测定:称取1.220g产品,配成100ml甲醇溶液,移取25.00ml溶液,滴定,消耗KOH的物质的量为2.40×10—3mol,产品中苯甲酸质量分数的计算表达式为 ,计算结果为 (保留二位有效数字)。
Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定存在。
Ⅰ.制备Na2S2O3·5H2O的反应原理:Na2SO3+S(s) Na2S2O3(aq)
Na2S2O3(aq)
实验步骤:
①称取15g Na2SO3加入圆底烧瓶中,再加入80mL蒸馏水,另取5g研细的硫粉,用3mL乙醇润湿,加入上述溶液中。
②安装实验装置(如图,部分加持装置略去),水浴加热,微沸60分钟。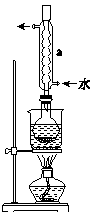
③趁热过滤,将滤液水浴加热浓缩,冷却析出Na2S2O3·5H2O,经过滤、洗涤,干燥,得到产品。
回答下列问题:
(1)硫粉在反应前用乙醇润湿的目的是 。
(2)仪器a的名称是 ,其作用是 。
(3)产品中除了有未反应的Na2SO3,外,最可能存在的无机杂质是 ,检验是否存在该杂质的方法是 。
(4)该实验一般控制在碱性环境下进行,否则产品发黄,用离子方程式表示其原因: 。
Ⅱ.测定产品纯度
准确称取Wg产品,用适量蒸馏水溶解,以淀粉做指示剂,用0.1000mol/L碘的标准溶液滴定,反应原理为
2S2O32-+I2=S4O62-+2I-。
(1)滴定至终点时,溶液颜色的变化: 。
(2)滴定起始和终点的液面位置如图,则消耗点的标准溶液体积为 mL,产品的纯度为(设的相对分子质量为M) 。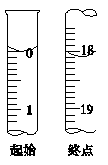
Ⅲ.Na2S2O3的应用
Na2S2O3还原性较强,在溶液中易被氯气氧化成硫酸根离子,常用作脱氧即,该反应的离子方程式为 。
某同学用中和滴定法测定某烧碱的纯度,实验过程如下:
(1)配制待测液:称取4.1 g固体烧碱样品(杂质不与酸反应)配制成250 mL溶液.
(2)滴定
①用____________量取10.00 mL待测液.
②向锥形瓶中加入几滴酚酞,用0.2010 mol·L-1的标准盐酸滴定待测烧碱溶液,边滴边摇动锥形瓶,眼睛注视锥形瓶内溶液颜色的变化,直到______________________时停止滴定.
(3)数据处理
| 实验次 序编号 |
盐酸溶液体积 V/mL |
氢氧化钠溶液体积 V/mL |
| 1 |
19.90 |
10.00 |
| 2 |
20.10 |
10.00 |
| 3 |
22.00 |
10.00 |
| 4 |
20.00 |
10.00 |
根据上述表格,选取合适的数据,计算待测烧碱溶液的浓度为________________,烧碱的纯度为________(保留两位小数)。
(4)一定物质的量浓度溶液的配制和酸碱中和滴定是中学化学中两个典型的定量实验。某研究性学习小组在实验室中配制盐酸标准溶液,然后用其滴定某未知浓度的NaOH溶液。下列有关说法中正确的是(多选)()
A.实验中所用到的滴定管、容量瓶,在使用前均需要检漏
B.如果实验中需用80 mL的稀盐酸标准溶液,配制时应选用100 mL容量瓶
C.容量瓶中含有少量蒸馏水,会导致所配标准溶液的浓度偏小
D.酸式滴定管用蒸馏水洗涤后,即装入标准浓度的稀盐酸,则测得的NaOH溶液的浓度将偏大
E.配制溶液时,定容时俯视读数,则导致实验结果偏大
F.中和滴定时,若在最后一次读数时俯视读数,则导致实验结果偏大
G.锥形瓶用蒸馏水洗浄后,有少量蒸馏水残留,则导致实验结果偏小
H.滴定前滴定管尖嘴有气泡,滴定后气泡消失,则导致实验结果偏大
某同学设计如图所示的实验方案:
(1)A装置的分液漏斗里盛装浓盐酸,烧瓶里固体为重铬酸钾(K2Cr2O7),还原产物是CrCl3,写出A中离子方程式:________________________________。
(2)本实验目的是_____________________ ,B装置有几个作用,分别是除去氯气中的氯化氢、 _________。拆去a导管的后果可能是______________________。
(3)装置C的功能是探究有氧化性的物质是否一定有漂白性,下列最佳试剂组合是________。
| ① |
② |
③ |
④ |
|
| Ⅰ |
湿润的红纸条 |
干燥的红纸条 |
干燥的红纸条 |
湿润的红纸条 |
| Ⅱ |
碱石灰 |
浓硫酸 |
硅胶 |
氯化钠 |
| Ⅲ |
湿润的红纸条 |
干燥的红纸条 |
干燥的白纸条 |
干燥的红纸条 |
(4)证明溴的非金属性比碘强的实验操作和现象是______________________
(5)D装置进行实验时存在明显不足,它是________________,合适的溶液X是____________(从①氢氧化钠溶液②亚硫酸钠溶液③亚硫酸氢钠溶液④氯化亚铁溶液⑤硫氢化钠溶液⑥碳酸氢钠溶液中选择)。
工业上用铝土矿(主要成分为Al2O3,Fe2O3等)提取Al2O3做冶炼铝的原料,由熔盐电解法获得的粗铝中含一定量的金属钠和氢气,这些杂质可采用吹气精炼法除去,产生的尾气经处理后可用于钢材镀铝.工艺流程如下图所示:
(已知:NaCl熔点为801℃;AlCl3在181℃升华)
(1)钢材镀铝后,抗腐蚀性能会大大增强,其原因是 .
(2)将Cl2连续通入坩埚中的粗铝熔体,杂质随气泡上浮而除去.气泡的主要成分除Cl2外还含有 ,固态杂质粘附于气泡上,在熔体表面形成浮渣,浮渣中肯定存在 .
(3)精炼前,需清除坩埚表面的氧化铁和石英砂,防止精炼时它们分别与铝发生置换反应产生新的杂质,则铝和氧化铁反应的化学方程式为 .
(4)向滤液中通入过量CO2所发生反应的离子方程式为 .
(5)镀铝电解池中,金属铝为阳极,熔融盐电镀液中铝元素主要以AlCl4﹣形式存在,则阳极的电极反应式为 .
草酸亚铁晶体的化学式为FeC2O4.2H2O,它是一种淡黄色结晶粉末,有轻微刺激性,加热时可发生如下分解反应:FeC2O4.2H2O FeO+CO2+CO+2H2O
FeO+CO2+CO+2H2O
(1)请你用下图中提供的仪器(可以重复选用,但每种仪器至少选用一次),选择必要的试剂[供选择的试剂:NaOH溶液、澄清石灰水、饱和碳酸钠溶液、CuO、无水硫酸铜、酸性高锰酸钾溶液],设计一个实验,检验FeC2O4·2H2O加热时分解产生的气态产物(包括水蒸气)(部分加热装置和夹持仪器在图中略去)。在答题卡上填写下表(可以不用填满,也可以补充)。
| 仪器符号 |
仪器中所加物质 |
作用 |
| A |
草酸亚铁晶体 |
加热草酸亚铁晶体得到气体产物 |
| D |
NaOH溶液 |
|
(2)按照题目提供的装置和要求设计的实验明显存在的一个不足是 。
(3)反应结束后,在A装置试管中有黑色固体粉末(混合物)产生,倒出时存在燃烧现象,产生上述现象的可能原因是 。