FeCl3在现代工业生产中应用广泛。某化学研究性学习小组模拟工业生产流程制备无水FeCl3,再用副产品FeCl3溶液吸收有毒的H2S。
I.经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。他们设计了制备无水FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:

①检查装置的气密性;②通入干燥的Cl2,赶尽装置中的空气;③用酒精灯在铁屑下方加热至反应完成;
④…… ⑤体系冷却后,停止通入Cl2,并用干燥的N2赶尽Cl2,将收集器密封。
请回答下列问题:
(1)装置A中反应的化学方程式为 。
(2)第③步加热后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管A的右端。要使沉积得FeCl3进入收集器,第④步操作是 。
(3)操作步骤中,为防止FeCl3潮解所采取的措施有(填步骤序号) 。
(4)装置B中的冷水作用为 ;装置C的名称为 ;装置D中FeCl2全部反应完后,因为失去吸收Cl2的作用而失效,写出检验FeCl2是否失效的试剂: 。
(5)在虚线框内画出尾气吸收装置E并注明试剂
Ⅱ.该组同学用装置D中的副产品FeCl3溶液吸收H2S,得到单质硫;过滤后,再以石墨为电极,在一定条件下电解滤液。
FeCl3与H2S反应的离子方程式为 。
(7)电解池中H+在阴极放电产生H2,阳极的电极反应为 。
(8)综合分析实验Ⅱ的两个反应,可知该实验有两个显著优点:
①H2S的原子利用率100%;② 。
实验室用Na2SO4·10H2O配制0.1mol/L的Na2SO4溶液500ml。有以下仪器:
①药匙②100ml量筒③1000ml容量瓶④锥形瓶⑤玻璃棒⑥烧杯
(1)配制时,必须选用的仪器为:(填代号),还缺少的玻璃仪器为
(2)经计算,本实验需称量硫酸钠晶体(Na2SO4·10H2O)为g。
(3)用Na2SO4·10H2O配制标准溶液的正确顺序是。
| A.冷却 | B.称量 | C.洗涤 | D.定容 E.溶解 F.摇匀 G.移液 |
(4)将所配制的Na2SO4溶液进行测定,发现浓度大于0.1mol/L。请你分析配制过程中可能引起该误差的原因是(填字母代号)
①容量瓶不干燥,含有少量蒸馏水②定容时俯视刻度线③定容时仰视刻度线④未冷却至室温就转移到容量瓶中⑤没有洗涤烧杯和玻璃棒
“碘钟”实验中,3I-+S2O82-=I3-+2SO42- 的反应速率可以用I3-与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20℃时进行实验,得到的数据如下表:
回答下列问题:
(1)该实验的目的是为了探究因素对化学反应速率的影响。
(2)显色时间t2=。
(3)温度对该反应的反应速率的影响符合一般规律,若在40℃下进行编号③对应浓度的实验,显色时间t2的范围为(填字母)
| A.<22.0s | B.22.0~44.0s | C.>44.0s | D.数据不足,无法判断 |
(4)通过分析比较上表数据,得到的结论是。
二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得。某学生拟用左下图所示装置模拟工业制取并收集ClO2。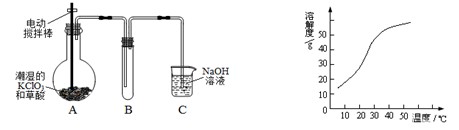
(1)A中反应产物有K2CO3、ClO2和CO2等,请写出该反应的化学方程式:。
(2)A必须添加温度控制装置,除酒精灯外,还需要的玻璃仪器有;B也必须添加温度控制装置,应该是装置。
(3)反应后在装置C中可得NaClO2溶液。已知NaClO2饱和溶液中在温度低于38℃时析出晶体是NaClO2·3H2O,在温度高于38℃时析出晶体是NaClO2。根据右上图所示的NaClO2的溶解度曲线,请补充从NaClO2溶液中制得NaClO2的操作步骤:
①;②;③洗涤;④干燥。
(4)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了下列实验:
步骤1:准确量取ClO2溶液10 mL,稀释成100 mL试样;量取V1 mL试样加入到锥形瓶中;
步骤2:调节试样的pH≤2.0,加入足量的KI晶体,静置片刻;
步骤3:加入淀粉指示剂,用c mol/L Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。(已知2 Na2S2O3 + I2 = Na2S4O6 + 2NaI)
①滴定过程中,至少须进行两次平行测定的原因是。
②原ClO2溶液的浓度为g / L(用含字母的代数式表示)。
如图为实验室制取蒸馏水的装置示意图,根据图示回答下列问题。
(1)图中有两处明显的错误是
①;②。
(2)A仪器的名称是,B仪器的名称是。
(3)实验时A中除加入少量自来水外,还需要加入少量的,其作用是。
(8分) 实验室里需要纯净的氯化钠溶液,但手边只有混有硫酸钠、碳酸氢铵的氯化钠。某学生设计了如下方案:
如果此方案正确,那么:
(1)操作①中碳酸氢铵受热(100℃以上)可分解生成氨气、水和二氧化碳的混合气,该混合气的平均摩尔质量为。(数值保留到小数点后一位)
(2)操作②为什么不能改为加硝酸钡溶液?__________________________________。
(3)操作③的目的是__________________________________(结合化学方程式回答)。
(4)操作④的目的是____________________________________________________。