(2014届安徽省安庆市六校高三第三次联考理综化学试卷)
硫代硫酸钠(Na2S2O3)可看成是一个S原子取代了Na2SO4中的一个O原子而形成。某校化学研究性学习小组运用类比学习的思想,通过实验探究Na2S2O3的化学性质。请填写以下空白:
【提出问题】Na2S2O3是否与Na2SO4相似具备下列性质呢?
猜想①:________________________。 猜想②:溶液呈中性,且不与酸反应。
猜想③:无还原性,不能被氧化剂氧化。
【实验探究】基于上述猜想②、③,设计实验方案。请填写下列表格中的(1)(2)(3)。
| |
实验操作 |
实验现象 或预期实验现象 |
现象解释 (用离子方程式表示) |
| 猜想② |
|
溶液pH约8—10 |
|
| 向pH=2的硫酸中滴加Na2S2O3溶液 |
|
S2O32—+2H+=S↓+SO2↑+H2O |
|
| 猜想③ |
向新制氯水(pH<2)中滴加少量Na2S2O3溶液 |
氯水颜色变浅 |
|
【实验结论】Na2S2O3能与酸反应,具有还原性,与Na2SO4的化学性质不相似。
【问题讨论】
(1)甲同学向探究“猜想③”反应后的溶液中滴加硝酸银溶液,观察到有白色沉淀产生,并据此认为氯水可将Na2S2O3氧化。你认为该方案是否正确并说明理由___________________________________。
(2)请重新设计一个实验方案,证明Na2S2O3被氯水氧化。该实验方案是 。
实验室以含有Mg2+、Cl—、Br—、SO42—等离子的卤水为主要原料制备Mg和Br2,流程如下: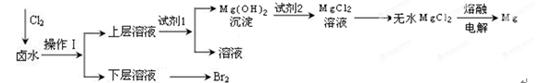
(1)操作Ⅰ使用的试剂是;所用主要仪器的名称是。
(2)为了使Mg2+转化为沉淀,试剂1可以选用;加入试剂1后,能够分离得到Mg(OH)2沉淀的方法是。
(3)试剂2可以选用。
(4)请写出由无水MgCl2生成Mg的化学反应方程式。
(8分)碘在科研与生活中有重要的应用。某兴趣小组用0.50mol·L-1KI 、0.2%淀粉溶液、0.20mol·L-1K2S2O8、0.10mol·L-1Na2S2O3等试剂,探究反应条件对化学反应速率的影响。已知S2O82—+2I—=2SO42—+I2(慢) I2 +2S2O32—=2I—+S4O62—(快)
(1)向KI 、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中(写离子符号)耗尽后,溶液颜色将由无色变为蓝色,为确保能观察到蓝色,S2O32—与S2O82—初始的物质的量需满足的关系为n(S2O32—)︰n(S2O82—)。
(2)为探究反应物浓度对化学反应速率的影响,设计的实验方案如下表:
| 实验 序号 |
体积/mL |
||||
| K2S2O8溶液 |
水 |
KI溶液 |
Na2S2O3溶液 |
淀粉溶液 |
|
| ① |
10.0 |
0.0 |
4.0 |
4.0 |
2.0 |
| ② |
9.0 |
1.0 |
4.0 |
4.0 |
2.0 |
| ③ |
8.0 |
VX |
4.0 |
4.0 |
2.0 |
表中VX=mL,理由是。
现有如下两个反应:(A)NaOH + HCl =" NaCl" + H2O
(B)2FeCl3 + Cu = 2FeCl2 + CuCl2
(1)根据两反应本质,判断能否设计成原电池(填“能”或“不能”)(A)(B)。
(2)如果(A或B)不能,说明其原因。
(3)如果(A或B)可以,则写出正、负极材料及其电极反应式,电解质溶液
负极:;。
正极:;。
电解质溶液:。
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯。回答下列问题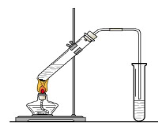
(1)在大试管中按一定比例将乙醇、乙酸混合后充分加热,在右边小试管中未收集到有香味的液体(气密性良好),原因可能是:。
(2)右边小试管中应加入的试剂是:;其作用是。
(3)下列描述能说明乙醇与乙酸的酯化反应已达到该反应的限度的有(填序号) 。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化
(4)海水化学资源的开发利用具有重要的意义和作用,下图是海带中提取碘的示意图: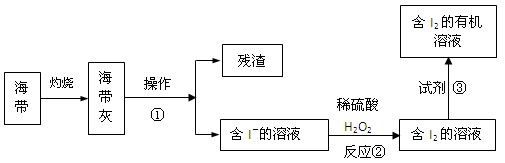
操作①的名称是;反应②的离子方程式是,下述物质中可做试剂③的是。
| A.乙醇 | B.苯 | C.乙酸 | D.四氯化碳 |
乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业。实验室利用右图的装置制备乙酸乙酯。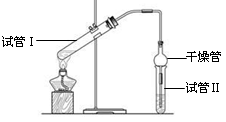
(1)与教材采用的实验装置不同,此装置中采用了球形干燥管,其作用是:。
(2)为了证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用上图所示装置进行了以下4个实验。实验开始先用酒精灯微热3min,再加热使之微微沸腾3min。实验结束后充分振荡小试管Ⅱ再测有机层的厚度,实验记录如下:
| 实验编号 |
试管Ⅰ中试剂 |
试管Ⅱ中 试剂 |
有机层的 厚度/cm |
| A |
2 mL乙醇、1 mL乙酸、 1mL18mol·L-1浓硫酸 |
饱和Na2CO3 溶液 |
3.0 |
| B |
2 mL乙醇、1 mL乙酸 |
0.1 |
|
| C |
2 mL乙醇、1 mL乙酸、 3 mL 2mol·L-1 H2SO4 |
0.6 |
|
| D |
2 mL乙醇、1 mL乙酸、盐酸 |
0.6 |
①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是______mL和_____mol·L-1。
②分析实验(填实验编号)的数据,可以推测出浓H2SO4的吸水性提高了乙酸乙酯的产率。
(3)若现有乙酸90g,乙醇138g发生酯化反应得到80g乙酸乙酯,试计算该反应的产率为______________。