(届内蒙古鄂尔多斯市高三第一次模拟考试理综化学试卷)
鄂尔多斯市已探明煤炭储量1496亿多吨,约占全国总储量的1/6。煤是重要的能源,也是生产化工产品的重要原料。试用所学知识,解答下列问题。
(1)煤的转化技术包括煤的气化技术和液化技术。煤的液化技术又分为 和 。
(2)在煤燃烧前需对煤进行脱硫处理。煤的某种脱硫技术的原理为
FeS2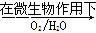 Fe2++SO42-
Fe2++SO42-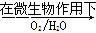 Fe3+
Fe3+
这种脱硫技术称为微生物脱硫技术。该技术的第一步反应的离子方程式为 ,第二步反应的离子方程式为 。
(3)工业煤干馏得到的产品有焦炭、 。
(4)工业上主要采用氨氧化法生产硝酸,如图是氨氧化率与氨-空气混合气中氧氨比的关系。其中直线表示反应的理论值;曲线表示生产实际情况。当氨氧化率达到100%,理论上r[n(O2)/n(NH3)]= ,实际生产要将r值维持在1.7~2.2之间,原因是 。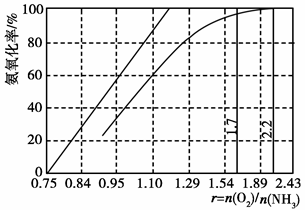
A、B、C、D、E、F、G、H、和I是中学化学中常见的气体,它们均由短周期元素组成,具有如下性质:
①A、B、E、F、G能使湿润的蓝色石蕊试纸变红,I能使湿润的红色石蕊试纸变蓝,C、D、H不能使 湿润的石蕊试纸变色;
②A和I相遇产生白烟
③B和E都能使品红溶液褪色
④将红热的铜丝放入装有B的瓶中,瓶内充满棕黄色的烟
⑤ 将点燃的镁条放入装有F的瓶中,镁条剧烈燃烧,生成白色粉末,瓶内壁附着黑色颗粒;
⑥ C和D相遇生成红棕色气体;
⑦ G在D中燃烧可以产生E和H2O
⑧ 将B和H 在瓶中混合后于光亮处放置几分钟,瓶内壁出现油状液滴并产生A。
回答下列问题:
(1)A的化学式是,②中白烟的化学式是;
(2) ④中发生反应的化学方程式是;
(3)⑤中发生反应的化学方程式是;
(4)C的化学式是,D的电子式是;
(5) ⑦中发生反应的化学方程式是;
(6) H的结构式是
实验室需要配制0.5 mol·L-1的烧碱溶液500 mL,根据溶液配制的过程,回答下列问题:
(1)实验中除了托盘天平(带砝码)、药匙、量筒和玻璃棒外,还需要的其他玻璃仪器有:________________________________________;
(2)根据计算得知,所需NaOH固体的质量为________g;
(3)配制溶液的过程中,有以下操作。其中正确的是________(填代号)。
A.将氢氧化钠固体放在纸片上称量
B.在烧杯中溶解氢氧化钠固体后,立即将溶液倒入容量瓶中
C.将溶解氢氧化钠的烧杯用蒸馏水洗涤2~3次,并将洗涤液转移到容量瓶中
离子反应是中学化学中重要的反应类型.回答下列问题:
(1)人们常用图示的方法表示不同反应类型之间的关系.如分解反应和氧化还原反应可表示为下左图.下右图为离子反应、氧化还原反应和置换反应三者之间的关系,则表示离子反应、氧化还原反应、置换反应的字母分别是________.
(2)将NaBr溶液加入AgCl沉淀中,产生AgBr黄色沉淀.从离子反应发生的条件分析,AgCl与AgBr相比较,溶解度较大的是________.
(3)离子方程式是重要的化学用语.下列是有关离子方程式的一些错误观点,请在下列表格中用相应的“离子方程式”否定这些观点.
反应物从下列物质中选取:Na、Fe、H2O、H2SO4、HCl、NaOH、Ba(OH)2、CuCl2(已知2Na+2H2O===2NaOH+H2↑).
| 错误观点 |
离子方程式 |
|
| ① |
所有的离子方程式均可以表示一类反应 |
|
| ② |
所有酸碱中和反应均可表示为:H++OH-===H2O |
(8分)某一反应体系有反应物和生成物共五种物质:
O2、H2CrO4、Cr(OH)3、H2O、H2O2.
已知该反应中H2O2只发生如下过程:H2O2―→O2.
(1)该反应中的还原剂是____________.
(2)该反应中,发生还原反应的过程是____________―→____________.
(3)写出该反应的化学方程式,并标出电子转移的方向和数目________________________________________________________________________.
(4)如反应转移了0.3 mol电子,则产生的气体在标准状况下体积为____________.
下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题: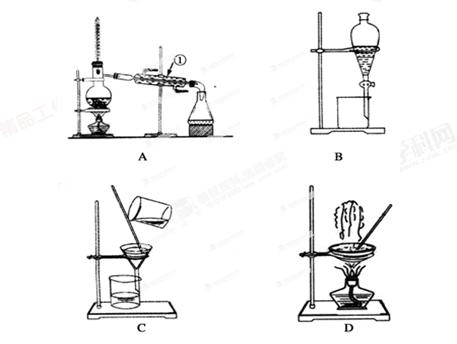
(1)从氯化钾溶液中得到氯化钾固体,选择装置________(填代表装置图的字母,下同);除去自来水中 的Cl-等杂质,选择装置________________。
(2)从碘水中分离出I2,选择装置________,该分离方法的名称为________________。
(3)装置A中①的名称是________,进水的方向是从________口进水。装置B在分液时为使液体顺利下滴,应进行的具体操作是_________________________________________。