(届山东省烟台市高三3月模拟化学试卷)
硼、镁及其化合物在工农业生产中应用广泛。
已知:硼镁矿主要成分为Mg2B2O5•H2O,硼砂的化学式为Na2B4O7•10H2O。利用硼镁矿制取金属镁及粗硼的工艺流程为:
回答下列有关问题:
(1)硼砂中B的化合价为 ,溶于热水后,常用H2SO4调pH2~3制取H3BO3,反应的离子方程式为 。X为H3BO3晶体加热脱水的产物,其与Mg制取粗硼的化学方程式为 。
(2)MgCl2·7H2O需要在HCl氛围中加热,其目的是 。若用惰性电极电解MgCl2溶液,其阴极反应式为 。
(3)镁-H2O2酸性燃料电池的反应机理为Mg+H2O2+2H+==Mg2++2H2O,则正极反应式为 。若起始电解质溶液pH=1,则pH=2时溶液中Mg2+离子浓度为 。已知Ksp[Mg(OH)2]=5.6 10-12,当溶液pH=6时 (填“有”或“没有”)Mg(OH)2沉淀析出。
10-12,当溶液pH=6时 (填“有”或“没有”)Mg(OH)2沉淀析出。
(4)制得的粗硼在一定条件下生成BI3,BI3加热分解可以得到纯净的单质硼。现将 0.020g粗硼制成的BI3完全分解,生成的I2用0.30mol·L-1 Na2S2O3(H2S2O3为弱酸)溶液滴定至终点,消耗Na2S2O3溶液18.00mL。盛装Na2S2O3溶液的仪器应为 滴定管(填“酸式”或“碱式”)。该粗硼样品的纯度为 。(提示:I2+2S2O32-=2I-+S4O62-)
某同学做元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验步骤”与“实验现象”前后不一定是对应关系)。
| 实验步骤 |
实验现象 |
| ①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 |
A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色。 |
| ②向新制得的Na2S溶液中满加新制的氯水 |
B.有气体产生,溶液变成浅红色 |
| ③ 将一小块金属钠放入滴有酚酞溶液的冷水中 |
C.剧烈反应,迅速产生大量无色气体. |
| ④ 将镁条投入稀盐酸中 |
D.反应不十分剧烈;产生无色气体。 |
| ⑤ 将铝条投入稀盐酸中 |
E.生成白色胶状沉淀,继而沉淀消失 |
| ⑥ 向A1Cl3溶液中滴加NaOH溶液至过量 |
F.生成淡黄色沉锭。 |
请你帮助该同学整理并完成实验报告。
(1)实验内容:(填写与实验步骤对应的实验现象的编号和②③的化学方程式)
| 实验内容 |
① |
② |
③ |
④ |
⑤ |
⑥ |
| 实验现象(填A~F) |
实验② ,
实验③ ;
(2)实验结论: 。
实验室可用NaBr、浓H2SO4、乙醇为原料制备少量溴乙烷:
C2H5—OH+HBr C2H5Br+H2O
C2H5Br+H2O
已知反应物的用量为:0.30 mol NaBr(s);0.25 mol C2H5OH(密度为0.80 g·cm-3);36 mL浓H2SO4(质量分数为98%,密度为1.84 g·mL-1);25 mL水。试回答下列问题。
(1)该实验应选择图中的a装置还是b装置?_____________。
(2)反应装置中的烧瓶应选择下列哪种规格最合适()
A.50 mL B.100 mL C.150 mL D.250 mL
(3)冷凝管中的冷凝水的流向应是()
A. A进B出 B. B进A出 C. 从A进或B进均可
(4)可能发生的副反应为:_____________、__________、______________(至少写出3个方程式)。
(5)实验完成后,须将烧瓶内的有机物蒸出,结果得到棕黄色的粗溴乙烷,欲得纯净溴乙烷,应采用的措施是_______ _________。
在实验室里制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,有人设计下列实验图以确认上述混合气体中有C2H4和SO2。
(1)Ⅰ、Ⅱ、Ⅲ、Ⅳ装置可盛放的试剂是Ⅰ________;Ⅱ________;Ⅲ________;Ⅳ________(将下列有关试剂的序号填入空格内);
| A.品红溶液 | B.NaOH溶液 | C.浓H2SO4 | D.酸性KMnO4溶液 |
(2)能说明SO2气体存在的现象是_______________;
(3)使用装置Ⅱ的目的是_________________;
(4)使用装置Ⅲ的目的是_________________;
(5)确定含有乙烯的现象是_________________。
回答下列问题。
(1)浓硫酸与木炭在加热条件下反应的化学方程式是_________________________
(2)试用下图所列各种装置设计一个实验来验证上述反应所产生的各种产物。
这些装置的连接顺序,按产物气流从左到右的方向是(填装置的编号):
_________→________→________→__________。
(3)实验时可观察到装置①中A瓶的溶液褪色c瓶的溶液不褪色。
A瓶溶液的作用是________________________________________,
B瓶溶液的作用是_____________________________________,
C瓶溶液的作用是_________________________________________。
(4)装置②中所装的固体药品是_____________,可以验证的产物是____________
(5)装置③中所盛溶液是_______________,可以验证的产物是___________。
(11分) 某同学做了如下实验:用三支试管、水槽、胶塞、导管、酒精喷灯及其它必要的仪器和物品,设计了以下实验装置,完成高温下“Fe与水蒸气的反应实验”。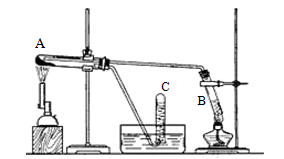
请回答该实验中的问题。
(1)写出该反应的反应方程式。
(1)试管A中装的试剂是;试管B中装的试剂是。
(2)试管C中收集气体的方法叫作;收集的气体是(填化学式)。
(3)如果要在气体导出管口点燃该气体,则必须对该气体进行。
(4)该同学欲确定反应后A试管中还原铁粉是否完全反应,其中的固体成分有哪些,设计了如下实验方案:(以下各空填化学式)
①待A试管冷却后,取少许其中的固体物质溶于稀硫酸得溶液x;
②取少量溶液x滴加KSCN溶液,若溶液变红色则说明A试管中固体物质一定有,若溶液未变红色则说明A试管中固体物质的成分是。
(5)该同学按上述实验方案进行了实验,结果溶液未变红色,原因是(用离子方程式表示)___________________________________________________________。