“物质结构与性质”模块
请回答下列问题:
(1)N、AI、Si、Zn四种元素中,有一种元素的电离能数据如下:

(2)则该元素是__①___(填写元素符号)。Zn原子的电子排布式是__②__。Ce的最高价氯化物分子式是___③___。该元素可能的性质或应用有__④___。
A.是一种活泼的金属元素
B.其电负性大于硫
C.其单质可作为半导体材料
D.其最高价氯化物的沸点低于其溴化物的沸点
(3)关于化合物 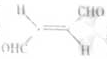 ,下列叙述正确的有 ⑤ 。
,下列叙述正确的有 ⑤ 。
A. 分子间可形成氢键
B. 分子中既有极性键又有非极性键
C. 分子中有7个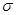 键和1个
键和1个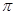 键
键
D. 该分子在水中的溶解度大于2-丁烯
(4)NaF的熔点 ⑥ 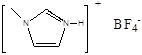 的熔点(填>、<或=),其原因是 ⑦
的熔点(填>、<或=),其原因是 ⑦
 超细氧化铝是一种重要的功能陶瓷原料。
超细氧化铝是一种重要的功能陶瓷原料。 (1)实验室常以
和
为原料,在一定条件下先反应生成沉淀
该沉淀高温分解即得超细
。
热分解的化学反应方程式。
(1)实验室常以
和
为原料,在一定条件下先反应生成沉淀
该沉淀高温分解即得超细
。
热分解的化学反应方程式。 (2)
的相对分子质量为453。欲配制100
为2、浓度约为0.1
的
溶液,配制过程为
(2)
的相对分子质量为453。欲配制100
为2、浓度约为0.1
的
溶液,配制过程为 ①用托盘天平称量
固体
;
①用托盘天平称量
固体
; ②将上述固体置于烧杯中。
②将上述固体置于烧杯中。 (3)在0.1
溶液中,铝各形态的浓度(以
计)的对数(
)随溶液
变化的关系见下图
(3)在0.1
溶液中,铝各形态的浓度(以
计)的对数(
)随溶液
变化的关系见下图

 ①用
溶液调节(2)中溶液
至7,该过程中发生反应的离子方程式有。
①用
溶液调节(2)中溶液
至7,该过程中发生反应的离子方程式有。 ②请在答题卡的框图中,画出0.01
溶液中铝各形态的浓度的对数
随溶液
变化的关系图,并进行必要的标注。
②请在答题卡的框图中,画出0.01
溶液中铝各形态的浓度的对数
随溶液
变化的关系图,并进行必要的标注。
 光催化制氢是化学研究的热点之一。科学家利用含有呲啶环(呲啶的结构式为
光催化制氢是化学研究的热点之一。科学家利用含有呲啶环(呲啶的结构式为 ,其性质类似于苯)的化合物II作为中间体,实现了循环法制氢,示意图如下(仅列出部分反应条件):
,其性质类似于苯)的化合物II作为中间体,实现了循环法制氢,示意图如下(仅列出部分反应条件):

 (1)化合物II的分子式为。
(1)化合物II的分子式为。 (2)化合物I合成方法如下(反应条件略,除化合物III的结构未标明外,反应式已配平);
(2)化合物I合成方法如下(反应条件略,除化合物III的结构未标明外,反应式已配平);

 化合物III的名称是。
化合物III的名称是。 (3)用化合物V(结构式见右图)代替III作原料,也能进行类似的上述反应,所得有机产物的结构式为。
(3)用化合物V(结构式见右图)代替III作原料,也能进行类似的上述反应,所得有机产物的结构式为。

 (4)下列说法正确的是(填字母)
(4)下列说法正确的是(填字母)
| A. | 化合物V的名称是间羟基苯甲醛,或2-羟基苯甲醛  |
B. | 化合物I具有还原性;II具有氧化性,但能被酸性高锰酸钾溶液氧化  |
C. | 化合物I、II、IV都可发生水解反应  |
D. | 化合物V遇三氯化铁显色,还可发生氧化反应,但不能发生还原反应 |
 (5)呲啶甲酸酯可作为金属离子的萃取剂。2-呲啶甲酸正丁酯(VI)的结构式见右图,其合成原料2-呲啶甲酸的结构式为;VI的同分异构体中,呲啶环上只有一个氢原子被取代的呲啶甲酸酯类同分异构体有种。
(5)呲啶甲酸酯可作为金属离子的萃取剂。2-呲啶甲酸正丁酯(VI)的结构式见右图,其合成原料2-呲啶甲酸的结构式为;VI的同分异构体中,呲啶环上只有一个氢原子被取代的呲啶甲酸酯类同分异构体有种。
已知X为FeO和CuO的混合物,取两份等质量的X样品进行下列实验: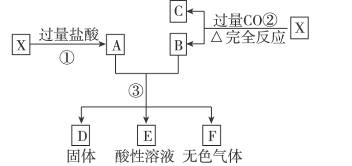
(1)写出①、②和③步所有反应的化学方程式。
(2)设第③步所得固体D的质量为32 g,溶液E中只含有一种金属离子,气体F在标准状况下体积为5.6 L,试计算取用的每份X的质量和X中FeO与CuO的质量比。
已知:A是硫酸盐,且A和G、C和D、F和H元素组成相同。G和KSCN溶液混合后溶液显血红色。反应过程中产生的水在图示中已略去。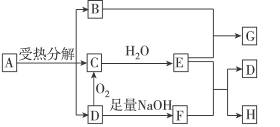
完成下列问题:
(1)写出G和H的化学式:G_____________,H_____________。
(2)工业生产中D转化为C的反应条件是:_____________。
(3)B跟E反应的离子方程式是_____________。
现有浓度均为1 mol·L-1的FeCl3、FeCl2、CuCl2的混合溶液各100 mL,加入一定量的铁粉,按下列情况填空:
(1)反应完毕后,铁粉有剩余。
①反应完毕后,溶液中一定含有_____________阳离子,为_____________mol,一定没有_____________阳离子;
②固体物质干燥后,其中一定有_____________,与反应前加入铁粉质量相比_____________(填“多”或“少”)_____________g。
(2)反应完毕后,有铜生成,铁粉无剩余。则反应完毕后溶液一定含有_____________阳离子,该阳离子在溶液中的物质的量范围是_____________。