(1) 元素的第一电离能:Al_Si(填“> ”或“< " )。
(2) 基态M 矿+的核外电子排布式为_。
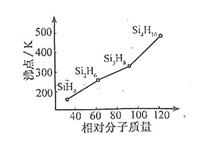
(3) 硅烷(SinH2n+2)的沸点与其相对分子质量的变化关系如右图所示,呈现这种变化关系的原因是_。
( 4 )硼砂是含结晶水的四硼酸钠,其阴离子Xm-(含B、0、H 三种元素)的球棍模型如右下图所示:
① 在Xm-中,硼原子轨道的杂化类型有 ;配位键存在于 原子之间(填原子的数字标号); m = (填数字)。
② 硼砂晶体由Na+、Xm-和H2O构成,它们之间存在的作用力有(填序号)。
A.离子键 B.共价键 C.金属键 D.范德华力 E.氢键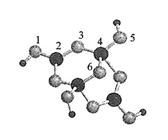
下图是几种粒子的结构示意图,观察它们的特征完成下列问题: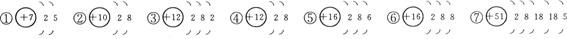
(1)属于原子的是________________________。
(2)属于阳离子的是________________________。
(3)属于阴离子的是________________________。
(4)属于稀有气体元素的是_________________ _______。
_______。
(5)属于同种元素的是___________ _____________。
_____________。
(6)属于金属元素的是________________________。
(7)属于非金属元素的是_________ _______________。
_______________。
下列粒子结构示意图能表示原子的是_________;表示阳离子的是_________;表示阴离子的是_________。
按要求用正确的化学符号表示:
(1)2个氮原子_____。(2)铵根离子_____。(3)地壳中含量最多的金属元素。_____ (4)1个硫酸分子____。(5)构成氯化钠晶体的阴离子____。(6)由硫离子与亚铁离子构成的物质___
100余种元素组成了数千万种的物质,这些物质可简单分成下列几类,请完成下表
| 宏观组成 |
微观构成(由分子构成的物质) |
举例 |
|
| 纯净物 |
|||
| 混合物 |
|||
| 单质 |
|||
| 化合物 |
|||
| 氧化物 |
元素周期表是学习和研究化学的重要工具,它的内容十分丰富,请你对元素周期表进行研究,并完成下列问题。
(1)原子序数为17的元素名称是______,它属于______(填“金属”或“非金属”)元素。
(2)研究元素周期表,你会发现如下规律:①原子序数与元素原子的核电荷数在数值上相等;②_____________________________;③_______________________