X、Y、Z、M、N、Q为元素周期表前四周期的六种元素。其中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,M的内层电子数是最外层电子数的9倍,N的原子序数比M小1, Q在元素周期表的各元素中电负性最大。请回答下列问题:
(1)X元素在周期表中的位置是 ,属于 区元素,它的外围电子的电子排布图为 。
(2)XZ2分子的立体结构是 ,YZ2分子中Y的杂化轨道类型为 ,相同条件下两者在水中的溶解度较大的是 (写分子式),理由是 。
(3)含有元素N的盐的焰色反应为 色,许多金属盐都可以发生焰色反应,其原因是 。
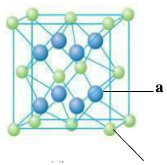
(4)元素M与元素Q形成晶体结构如图所示,设其晶胞边长为a pm,则a位置与b位置之间的距离为_______pm(只要求列算式)。
(共10分)某温度时,在2 L密闭容器中某一反应的A、B物质的量随时间变化的曲线如图所示:
由图中数据分析求:
(1)该反应的化学方程式为。
(2)反应开始 至4 min时,A的平均反应速率为。(要求写出计算过程)
至4 min时,A的平均反应速率为。(要求写出计算过程)
(3)第4min末时A、B的物质的量浓度依次为________、________。第4 min时,正、逆反应速率的大小关系为:v(正)________v(逆)(填“>”、“<”或“=”,下同),第8 min时,v(正)________v(逆)。
(共13分)A、B、C、D 四种元素的原子序数均≤20,A元素所处的周期数、主族序数、原子序数均相等;B的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层少2个,C的阴离子与D的阳离子具有相同的电子层结构,两元素可形成化合物D2C.
(1)B在周期表中的位置为:;
(2)A、B形成的化合物的结构式, D2C含有的化学键类型为,用电子式表示D2C的形成过程 。
。
(3)C与D的原子中,半径更大的是:(用相应的元素符号填空);
(4)A与D形成的化合物投入滴有酚酞的水中时,能剧烈反应产生气体,反应后溶液显红色。该反应的化学方程式为:。
(共10分)下表是A、B、C、D、E五种有机物的有关信息:
| A |
①能使溴的四氯化碳溶液褪色 ②比例模型如图 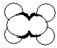 ③能与水在一定条件下反应生成C |
| B |
①由C、H两种元素组成 ②球棍模型如图 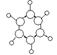 |
| C |
①由C、H、O三种元素组成 ②能与Na反应 ③与E反应生成相对分子质量为88的酯 |
| D |
①相对分子质量比C少2 ②能由C催化氧化得到 |
| E |
①由C、H、O三种元素组成 ②其水溶液能使紫色石蕊试液变红 |
回答下列问题:
(1)A~E中,属于烃的是__________(填字母)。
(2)A能使溴的四氯化碳溶液褪色,发生反应的化学方程式为_______________________。
(3)C催化氧化生成D的化学方程式为________________________。
(4)有机物B具有的性质是_____________(填序号)。
①无色无味的溶液;②有毒;③不溶于水;④密度比水大;
⑤能使酸性KMnO4溶液和溴水褪色。
(5)E的水溶液能使紫色石蕊试液变红,说明E的水溶液显酸性,现设计一个实验来比较E与碳酸酸性的强弱,则该实验的原理是_____________________________(用化学方程式说明)。
(1)O22+与N2互为等电子体, O22+的电子式可表示为; O22+中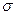 键数目和
键数目和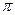 键数目之比为。
键数目之比为。
(2)将乙炔通入[Cu(NH3)2]Cl溶液生成红棕色沉淀Cu2C2。Cu+基态核外电子排布式为; Cu+的配位数为。
(3)乙炔与氢氰酸反应可得丙烯腈 。丙烯腈分子中碳原子轨道杂化类型是。
。丙烯腈分子中碳原子轨道杂化类型是。
(4)在合成氨反应中,催化剂铁表面上存在氮原子,如图为氮原子在铁的晶面上的单层附着局部示意图(图中小黑色球代表氮原子,灰色球代表铁原子)。则在图示状况下,铁颗粒表面上N/Fe原子数比为。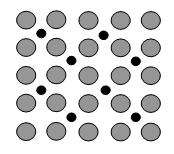
某化学反应 3 A(g)  2 B(g) + D(g),在四种不同条件下进行,B 、D的起始浓度为0。反应物A 的浓度 c 随时间 t 的变化情况如下表:
2 B(g) + D(g),在四种不同条件下进行,B 、D的起始浓度为0。反应物A 的浓度 c 随时间 t 的变化情况如下表: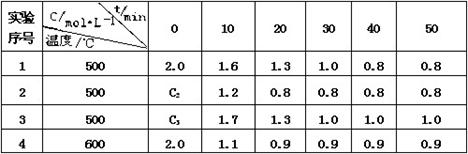
根据上述数据,完成下列填空:
(1)在实验 1,反应在10 min ~20 min 内平均速率v(A)为mol/(L·min)
(2)在实验 2 ,A 的初始浓度 C2 mol/L ,反应经 20 min 就达到平衡,可推测实验 2 中还隐含的条件是。
(3)设实验 3 的反应速率为v3,实验 1 的反应速率为v1,则v3 v1 (填<、>或=),
且C32.0 mol / L (填<、>或=)
(4)比较实验 4 和实验 1,可推测正反应是反应(填吸热或放热)。理由是
(5)该反应化学平衡常数表达式为。