利用废旧锌铁皮制备磁性Fe3O4胶体粒子及副产物ZnO。制备流程图如下:

已知:Zn及化合物的性质与Al及化合物的性质相似。请回答下列问题:
(1)用NaOH溶液处理废旧锌铁皮的作用有 。
| A.去除油污 | B.溶解镀锌层 | C.去除铁锈 | D.钝化 |
(2)调节溶液A的pH可产生Zn(OH)2沉淀,为制得ZnO,后续操作步骤是 。
(3)由溶液B制得Fe3O4胶体粒子的过程中,须持续通入N2,原因是 。
(4)Fe3O4胶体粒子能否用减压过滤发实现固液分离? (填“能”或“不能”),理由是 。
(5)用重铬酸钾法(一种氧化还原滴定法)可测定产物Fe3O4中的二价铁含量。若需配制浓度为0.01000 mol·L-1的K2Cr2O7标准溶液250 mL,应准确称取 g K2Cr2O7(保留4位有效数字,已知M(K2Cr2O7)=294.0 g·mol-1)。
配制该标准溶液时,下列仪器中不必要用到的有 。(用编号表示)。
①电子天平 ②烧杯 ③量筒 ④玻璃棒 ⑤容量瓶 ⑥胶头滴管 ⑦移液管
(6)滴定操作中,如果滴定前装有K2Cr2O7标准溶液的滴定管尖嘴部分有气泡,而滴定结束后气泡消失,则测定结果将 (填“偏大”、“偏小”或“不变”)。
实验室可以用高锰酸钾和浓盐酸反应制取氯气,反应的化学方程式如下:
2KMnO4+16HCl(浓) 2KCl + 2MnCl2 + 5Cl2↑ +8H2O
(1)用单线桥法标出电子转移的方向和数目。
(2)该反应中的氧化剂与还原剂物质的量之比是。
(3)KMnO4的氧化性比Cl2的氧化性(选填“强”或“弱”)。
(4)如反应中转移了2mol电子,则产生的Cl2在标准状况下体积为L。
(5)某同学欲用KMnO4固体配制100 mL0.5mol.L-1的溶液。回答下列问题:
①配制KMnO4溶液时需用的主要仪器有托盘天平、药匙、烧杯、玻璃棒、量筒、、。
②应用托盘天平称取KMnO4固体g。
③不规范的实验操作会导致实验结果的误差。分析下列操作对实验结果的影响偏小的是(请填序号)。
| A.加水定容时俯视刻度线 |
| B.容量瓶内壁附有水珠而未干燥处理 |
| C.颠倒摇匀后发现凹液面低于刻度线又加水补上 |
| D.在溶解过程中有少量液体溅出烧杯外 |
(11分)(1)下图分别是温度计、量筒、滴定管的一部分,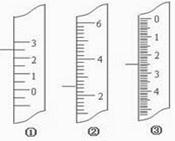
则:量筒应该是读数为mL,滴定管应该是读数为mL,温度计应该是。
(2)实验室有一瓶混有氯化钠的氢氧化钠固体试剂,为了验证其纯度,用已知浓度的盐酸进行滴定,试回答下列问题:
①称取一定质量固体试剂配制100mL溶液。
②将标准盐酸装在25.00mL滴定管中,调节液面位置在,并记下刻度。
③取20.00mL待测液,待测定。该项实验操作的主要仪器有。
用试剂作指示剂。
④下列实验操作会引起氢氧化钠含量偏高的是。
| A.滴定前滴定管尖嘴有气泡,滴定后滴定管尖嘴无气泡 |
| B.中和滴定时,锥形瓶内有少量蒸馏水 |
| C.酸式滴定管用蒸馏水洗后,用标准液润洗2-3次 |
| D.读取滴定管终点读数时,仰视刻度线 |
某学生用已准确称量的2.000g烧碱固体配制一定物质的量浓度的溶液500mL。实验室提供以下仪器:
①100mL烧杯 ②100 mL量筒 ③1000 mL容量瓶 ④500 mL容量瓶 ⑤玻璃棒 ⑥托盘天平(带砝码)。
请回答下列问题:
(1)配制时,必须使用的仪器有_________(填代号),还缺少的仪器是 (填仪器名称);
(2)配制时正确的操作顺序是(字母表示,每个操作只用一次);
| A.用少量水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡 |
| B.在盛有NaOH固体的烧杯中加入适量水溶解 |
| C.将烧杯中已冷却的溶液沿玻璃棒注入容量瓶中 |
| D.将容量瓶盖紧,反复上下颠倒,摇匀 |
E.改用胶头滴管加水,使溶液凹面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
(3)实验中两次用到玻璃棒,其作用分别是:先用于________,后用于________;
(4)若出现如下情况,其中将引起所配溶液浓度偏高的是;(填下列编号)
①容量瓶实验前用蒸馏水洗干净,但未烘干
②定容观察液面时俯视
③配制过程中遗漏了(2)中步骤A
(5)计算:该烧碱溶液的物质的量浓度为。
用滴管将新制的饱和氯水慢慢滴入酚酞的氢氧化钠稀溶液中,当滴到最后一滴时红色突然褪去,试回答下列问题:
(1)实验室保存饱和氯水的方法是。
(2)产生上述现象的原因可能有两种(用文字简要说明):
①、
②、
(3)简述怎样用实验证明红色褪去的原因是①或②:
实验室要用98%(ρ="1.84" g·cm-3)的硫酸配制3.68 mol·L-1的硫酸溶液400mL
(1)计算所需98%的硫酸mL
(2)该实验中除了要用到量筒、烧杯以外,还需要用到的玻璃仪器(无需装瓶)有:、、。
(3)若配制3.68mol·L-1的硫酸溶液的其他操作均正确,但出现下列错误操作,将导致所配制的硫酸溶液浓度偏低的是。
| A.浓硫酸溶解后未冷却,直接转移至容量瓶后定容 |
| B.将烧杯内的稀硫酸向容量瓶中转移时,因操作不当使部分稀硫酸溅出瓶外 |
| C.用量筒量取浓硫酸时,俯视读数 |
| D.容量瓶使用前用3.68mol·L-1硫酸的溶液润洗 |