实验室要用98%(ρ="1.84" g·cm-3)的硫酸配制3.68 mol·L-1的硫酸溶液400mL
(1)计算所需98%的硫酸 mL
(2)该实验中除了要用到量筒、烧杯以外,还需要用到的玻璃仪器(无需装瓶)有: 、 、 。
(3)若配制3.68mol·L-1的硫酸溶液的其他操作均正确,但出现下列错误操作,将导致所配制的硫酸溶液浓度偏低的是 。
| A.浓硫酸溶解后未冷却,直接转移至容量瓶后定容 |
| B.将烧杯内的稀硫酸向容量瓶中转移时,因操作不当使部分稀硫酸溅出瓶外 |
| C.用量筒量取浓硫酸时,俯视读数 |
| D.容量瓶使用前用3.68mol·L-1硫酸的溶液润洗 |
某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体。为此,他们设计了如下装置验证所产生的气体。
(1)填写装置的作用:B ,C ,G ,
(2)证明有SO2生成的现象是
(3)可以证明气体X中含有氢气的实验现象是:E中:_____________,F中:__________。如果去掉装置D,还能否根据F中的现象判断气体中有氢气?________(填“能”或“不能”),原因是_________。
(4)反应后A的溶液中含有Fe3+和Fe2+,检验其中的Fe2+的方法是 。
(5)若将铁丝换成铜丝,反应后的溶液没有出现预计的蓝色溶液,而出现了大量白色固体,原因是 ,要确认CuSO4生成,待试管冷却后, 。
取6根铁钉,6支干净的试管及其他材料,如图所示。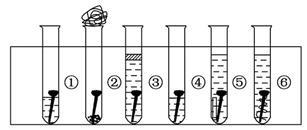
试管①放入一根铁钉,再注入蒸馏水,使铁钉和空气及水接触;
试管②在试管底部放入硅胶(是一种干燥剂),再放入铁钉,用棉花团堵住试管口,使铁钉和干燥空气接触;
试管③先放入一根铁钉,趁热倒入煮沸的蒸馏水(已赶出原先溶解在蒸馏水中的空气)浸没铁钉,再加上一层植物油,使铁钉不能跟空气接触;
试管④中放入铁钉注入食盐水,使铁钉和空气及食盐水接触;
试管⑤放入相连的铁钉和锌片,注入自来水,浸没铁钉和锌片;
试管⑥放入相连的铁钉和铜丝,注入自来水,浸没铁钉和铜丝。
把6支试管放在试管架上,几天后观察铁钉被腐蚀的情况。
(1)上述实验中铁钉发生了电化学腐蚀的是______ (填试管序号);在电化学腐蚀中,负极反应是________,正极反应是__________。
(2)从铁钉被腐蚀的情况可知引起和促进铁钉被腐蚀的条件是_____________。
(3)为防止铁的锈蚀,工业上普遍采用的方法是___________(答两种方法)。
乙酸异戊酯是组成蜜蜂信息素质的成分之一,具有香蕉的香味,实验室制备乙酸异戊酯的反应装置示意图和有关数据如下:
实验步骤:
在A中加入4.4 g的异戊醇,6.0 g的乙酸、数滴浓硫酸和2~3片碎瓷片,开始缓慢加热A,回流50分钟,反应液冷至室温后,倒入分液漏斗中,分别用少量水,饱和碳酸氢钠溶液和水洗涤,分出的产物加入少量无水硫酸镁固体,静置片刻,过滤除去硫酸镁固体,,进行蒸馏纯化,收集140~143 ℃馏分,得乙酸异戊酯3.9 g。回答下列问题:
(1)装置B的名称是:
(2)在洗涤操作中,第一次水洗的主要目的是: ;第二次水洗的主要目的是: 。
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后 (填标号),
A.直接将乙酸异戊酯从分液漏斗上口倒出
B.直接将乙酸异戊酯从分液漏斗下口放出
C.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
D.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口放出
(4)本实验中加入过量乙酸的目的是:
(5)实验中加入少量无水硫酸镁的目的是:
(6)在蒸馏操作中,仪器选择及安装都正确的是: (填标号)
(7)本实验的产率是:
A.30℅B.40℅C.50℅D.60℅
(8)在进行蒸馏操作时,若从130 ℃开始收集馏分,产率偏 (填高或者低)原因是 。
硅孔雀石的主要成分为CuCO3•Cu(OH)2和CuSiO3•2H2O,还含有SiO2、FeCO3、Fe2O3、Al2O3等杂质。以硅孔雀石为原料制取硫酸铜的工艺流程如下: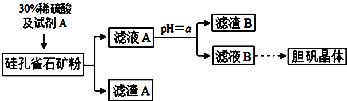
部分氢氧化物开始沉淀和完全沉淀的pH如下表
| 氢氧化物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Cu(OH)2 |
| 开始沉淀的pH |
3.3 |
1.5 |
6.5 |
4.2 |
| 完全沉淀的pH |
5.2 |
3.7 |
9.7 |
6.7 |
请回答下列问题:
(1)滤渣B的主要成分是 (用化学式表示);判断本实验能否调节溶液pH使杂质完全除去而不损失Cu2+,并简述理由 。
(2)用离子方程式表示加入绿色氧化剂A的作用 。
(3)可向滤液A中加入 (填字母)调节PH以除去杂质
a.氨水b.氧化铜 c.氢氧化钠d.氢氧化铜
(4)从滤液B中提取胆矾的操作包括 、用乙醇洗涤、用滤纸吸干等。
(5)测定产品纯度和胆矾中结晶水数目
①沉淀法测定产品纯度
取一定质量的样品溶于蒸馏水,加入足量的BaCl2溶液和稀硝酸,过滤、洗涤、干燥、称重,实验结果发现测得的产品纯度偏高,可能的原因是 填字母)
a.产品失去部分结晶水 b.产品中混有CuCl2•2H2O
c.产品中混有Al2(SO4)3•12H2Od.产品中混有Na2SO4
②差量法测得结晶水数目
取ag样品盛装在干燥的坩锅里,灼烧至结晶水全部失去,称得无水硫酸铜的质量b g,则胆矾(CuSO4•nH2O)中n值的表达式为 。
硫酸亚铁铵是一种浅蓝绿色晶体,俗称摩尔盐。其化学式为:FeSO4•(NH4)2SO4•6H2O硫酸亚铁在空气中易被氧化,而形成摩尔盐后就稳定了。硫酸亚铁铵可由硫酸亚铁与硫酸铵等物质的量混合制得。三种盐的溶解度(单位为g/100g水)如下表:
| 温度/℃ |
10 |
20 |
30 |
40 |
50 |
70 |
| (NH4)2SO4 |
73.0 |
75.4 |
78.0 |
81.0 |
84.5 |
91.9 |
| FeSO4•7H2O |
40.0 |
48.0 |
60.0 |
73.3 |
- |
- |
| 摩尔盐 |
18.1 |
21.2 |
24.5 |
27.9 |
31.3 |
38.5 |
如图是模拟工业制备硫酸亚铁铵晶体的实验装置
回答下列问题:
Ⅰ.(1)先用30%的氢氧化钠溶液煮沸废铁屑(含少量油污、铁锈、FeS等),再用清水洗净,用氢氧化钠溶液煮沸的目的是 。将处理好的铁屑放入锥形瓶中,加入稀硫酸,锥形瓶中发生反应的离子方程式可能为 (填序号)
A.Fe + 2H+=Fe2+ +H2↑B.Fe2O3+6H+=2Fe3++3H2O
C.2Fe3++H2S=2Fe2++S↓+2H+ D.2Fe3++Fe=3Fe2+
(3)利用容器②的反应,向容器①中通入氢气,应关闭活塞 ,打开活塞 (填字母)。容器③中NaOH溶液的作用是 ;向容器①中通人氢气的目的是 。
Ⅱ.待锥形瓶中的铁屑快反应完时,关闭活塞B、C,打开活塞A,继续产生的氢气会将锥形瓶中的硫酸亚铁(含极少部分未反应的稀硫酸)压到饱和硫酸铵溶液的底部。在常温下放置一段时间,试剂瓶底部将结晶出硫酸亚铁铵。硫酸亚铁与硫酸铵溶液混合就能得到硫酸亚铁铵晶体,其原因是 ;从容器①中分离并得到纯净硫酸亚铁铵晶体的操作方法是 。
Ⅲ.制得的硫酸亚铁铵晶体中往往含有极少量的Fe3+,为测定晶体中Fe2+的含量,称取一份质量为20.0g的硫酸亚铁铵晶体样品,制成溶液。用0.5mo1/LKMnO4溶液滴定,当溶液中Fe2+全部被氧化,MnO‾4被还原成Mn2+时,耗KMnO4溶液体积20.00mL.滴定时,将KMnO4溶液装在 (填酸式或碱式)滴定管中,判断反应到达滴定终点的现象为 ;晶体中FeSO4的质量分数为 。