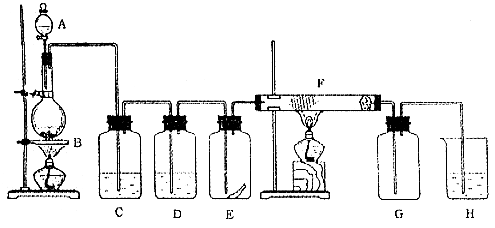
三氯化铬是化学合成中的常见物质,三氯化铬易升华,在高温下能被氧气氧化,碱性条件下能被H 2O 2氧化为Cr(Ⅵ)。制三氯化铬的流程如下:

(1)重铬酸铵分解产生的三氧化二  铬(Cr 2O 3难溶于水)需用蒸馏水洗涤的原因 ,如何用简单方法判断其已洗涤干净 。
铬(Cr 2O 3难溶于水)需用蒸馏水洗涤的原因 ,如何用简单方法判断其已洗涤干净 。
(2)已知CCl 4沸点为57.6℃,为保证稳定的CCl 4气流,适宜的加热方式是 。
(3)用右图装置制备CrCl 3时:

主要步骤包括:①将产物收集到蒸发皿中;②加热反应管至400℃,开始向三颈烧  瓶中通人氮气,使CCl 4蒸气经氮气载人反应室进行反应,继续升温到650℃;③三颈烧瓶中装入150mLCCl 4,并加热CCl 4,温度控制在5
瓶中通人氮气,使CCl 4蒸气经氮气载人反应室进行反应,继续升温到650℃;③三颈烧瓶中装入150mLCCl 4,并加热CCl 4,温度控制在5  0~60℃之间;④反应管出口端出现了CrCl 3升华物时,切
0~60℃之间;④反应管出口端出现了CrCl 3升华物时,切
断加热管式炉的电源;⑤停止加热CCl 4,继续通人氮气; ⑥检查装置气密性。正确的顺序为:⑥→③→ 。
(4)已知反应管中发生的主要反应有:Cr 2O 3+ 3CCl 4→ 2CrCl 3+ 3COCl 2,因光气剧毒,实验  需在通风橱中进行,并用乙醇处理COCl 2,生成一种含氧酸酯(C 5H 10O 3),用乙醇处理尾气的化学方程式为 。
需在通风橱中进行,并用乙醇处理COCl 2,生成一种含氧酸酯(C 5H 10O 3),用乙醇处理尾气的化学方程式为 。
(5)样品中三氯化铬质量分数的测定
称取样品0.3300g,加水溶解并定容于250mL容量瓶中。移取25.00mL于碘量瓶(一种带塞的  锥形瓶)中,加热至沸后加入1gNa 2O 2,充分加热煮沸,适当稀释,
锥形瓶)中,加热至沸后加入1gNa 2O 2,充分加热煮沸,适当稀释,  然后加入过量的2mol/LH 2SO 4至溶液呈强酸性,此时铬以Cr 2O
然后加入过量的2mol/LH 2SO 4至溶液呈强酸性,此时铬以Cr 2O  存在,再加入1.1gKI,密塞,摇匀,于暗处静置5分钟后,加入1mL指示剂,
存在,再加入1.1gKI,密塞,摇匀,于暗处静置5分钟后,加入1mL指示剂,  用0.0250mol/L硫代硫酸钠溶液滴定至终点,平行测定三次,平均消耗标准硫代硫酸钠溶液24.00mL。
用0.0250mol/L硫代硫酸钠溶液滴定至终点,平行测定三次,平均消耗标准硫代硫酸钠溶液24.00mL。
已知:Cr 2O  +6I -+14H +=2Cr 3++3I 2+7H 2O,2Na 2S 2O 3+I 2===Na 2S 4O 6+2NaI。
+6I -+14H +=2Cr 3++3I 2+7H 2O,2Na 2S 2O 3+I 2===Na 2S 4O 6+2NaI。
①该实验可选用的指示剂名称为 。
②移入碘量瓶的CrCl 3溶液需加热煮沸,加入Na 2O  2后也要加热煮沸,其主要原因是 。
2后也要加热煮沸,其主要原因是 。
③样品中无  水三氯化铬的质量分数为 。
水三氯化铬的质量分数为 。
掌握仪器的名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。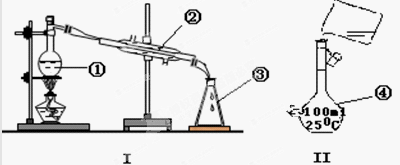
⑴写出下列仪器的名称:
①____________;②_____________;④__________;
⑵仪器①~④中,使用时必须检查是否漏水的有______。(填序号)
⑶若利用装置I分离四氯化碳和乙醇的混合物,还缺少的仪器是_________,将仪器补充完整后进行的实验操作的名称为_____________ 。现需配制250 mL 0.2 mol/L NaCl溶液,装置II是某同学转移溶液的示意图,图中的错误是______________、_________________ 。
用18.4mol/L的浓硫酸稀释成0.92mol/L的稀硫酸100ml,回答下列问题:
(1)
| 应取浓硫酸的体积/ml |
应选用容量瓶的规格/mL |
除容量瓶外还需要的其它仪器 |
(2)配制操作可分解成如下几步:
A.向容量瓶中注入少量蒸馏水,检查容量瓶是否漏水
B.用少量蒸馏水洗涤烧杯,将溶液注入容量瓶,并重复操作两次
C.将已冷却的硫酸注入容量瓶中
D.根据计算,用量筒量取一定体积的浓硫酸
E.将浓硫酸沿烧杯壁慢慢注入盛有蒸馏水的小烧杯中,并不断用玻璃棒搅拌
F.盖上容量瓶塞子,振荡,摇匀,装瓶
G.用胶头滴管继续加蒸馏水,使溶液凹面恰好与刻度相切
H.继续往容量瓶中小心地加蒸馏水,使液面接近刻度线
正确的操作顺序是:A____________________________F
(3)下列操作结果,使溶液物质的量浓度偏低的是
A.没有将洗涤液转移到容量瓶中
B.容量瓶洗净后未经干燥处理
C.转移过程中有少量的溶液溅出
D.摇匀后立即观察,发现溶液未达刻度线,没有再用滴管加几滴蒸馏水至刻度线
实验室需要0.1mol/LNaOH溶液450mL和0.5mol/L硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是 ______(填序号),配制上述溶液还需用到的玻璃仪器是________(填仪器名称)。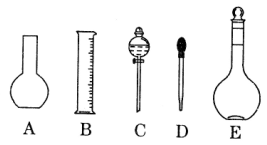
(2)下列操作中,容量瓶所不具备的功能有_________(填序号)。
A.配制一定体积准确浓度的标准溶液
B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体
D.准确稀释某一浓度的溶液
E.用来加热溶解固体溶质
(3)根据计算用托盘天平称取NaOH的质量为__________g。配制时,其正确的操作顺序是字母表示,
每个字母只能用一次)____________。
A.用30mL水洗涤烧杯2-3次,洗涤液均注入容量瓶
B.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
C.将溶解的氢氧化钠溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度2~3cm处
(4)根据计算得知,所需质量分数为98%、密度为1.84g/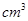 的浓硫酸的体积为:__________mL(计算
的浓硫酸的体积为:__________mL(计算
结果保留一位小数)。如果实验室有15mL、20mL、50mL量筒,应选用____________mL的量筒最好。
某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯:
已知:
| 密度 (g/cm3) |
熔点 (℃) |
沸点 (℃) |
溶解性 |
|
| 环己醇 |
0.96 |
25 |
161 |
能溶于水 |
| 环己烯 |
0.81 |
-103 |
83 |
难溶于水 |
(1)制备粗品
将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是 ,导管B除了导气外还具有的作用是。
②试管C置于冰水浴中的目的是 。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在层(填“上”或“下”),分液后用(填入编号)洗涤。
A.KMnO4溶液 B.稀H2SO4 C.Na2CO3溶液
②再将环己烯按图装置蒸馏,冷却水从口进入。蒸馏时要加入生石灰,目的是:。
③收集产品时,控制的温度应在左右,实验制得的环己烯精品质量低于理论产量,可能的原因是 _______
A.蒸馏时从70℃开始收集产品 B.环己醇实际用量多了
C.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是_______
A.用酸性高锰酸钾溶液B.用金属钠 C.测定沸点
(4)由环己烯再转化为环己醇的化学方程式为:______________
下图为实验室制取纯净、干燥的Cl2,并进行检验Cl2性质实验的装置。其中E瓶中放
有干燥红色布条;F中为铜网,右端为一团棉花。
|
|