(原创)Na2SO3因易被氧化成Na2SO4而变质,某化学兴趣小组为了测定实验室存放的Na2SO3的纯度(假设不含其它杂质),进行如下实验。
准确称取样品m g,用蒸馏水溶解,配成250mL溶液,准确量取25.00mL,用0.1000mol/L碘的标准溶液滴定,滴定操作分为如下步骤:
①准确量取25.00 mL待测的Na2SO3溶液注入洁净的锥形瓶,并加入2~3滴指示剂
②用标准液溶液润洗滴定管2~3次
③把盛有标准溶液的酸式滴定管固定好,调节液面使滴定管尖嘴充满溶液
④取标准碘溶液注入酸式滴定管至0刻度以上
⑤调节液面至0或0刻度以下,记下读数
⑥把锥形瓶放在滴定管的下方,用标准碘溶液滴定至终点,记下滴定管液面的刻度
重复以上操作2~3次。
回答以下问题:
(1)正确操作顺序是: 。
(2)待测液应该用 式滴定管量取。
(3)选择 作指示剂,判断达到滴定终点的现象是
(4)其中一次滴定的起始和终点液面如下图所示,则消耗标准溶液的体积V= mL。样品中Na2SO3的质量分数为 (用含m、V的代数式表示)。
(5)下列失误操作会使实验结果偏大的是
| A.滴定前,用待测液润洗锥形瓶 |
| B.滴定前,未用待测液润洗滴定管 |
| C.滴定结束时,俯视读数 |
| D.配制标准碘溶液定容时,仰视刻度线 |
(6)若滴定操作时间过长,会使实验结果偏小,原因是:_________________________
(用化学反应方程式解释)。
(7)请另外设计一种实验方案,测定Na2SO3的纯度。简要说明实验步骤、所用试剂以及所测数据。________________________________________________________________
____________________________________________________________。
某厂利用一种天然产物进行发酵,发现发酵液中含有U、V、W、X等多种化合物。已知:①U和W均可与银氨溶液反应,析出金属银,而且U是一种单糖;②V是个单官能团化合物,其碳原子数和X相同,V在浓硫酸作用下经加热得到Y,Y可以使溴水褪色;③V经缓和氧化可以生成W;④V和X在少量浓H2SO4作用下经加热可以得到Z;⑤X的组成为:C:40%、H:6.7%、O:53.3%,X含有一个羧基,并知450 mg X与25 mL 0.20 mol/L与NaOH溶液完全反应,X也可和乙醇起酯化反应。根据上述条件:
(1)写出符合U的一种可能的单糖结构简式:_______________。
(2)X的分子式是_______________,其所有可能的结构简式是____________________。
(3)V、W、Y、Z的可能结构简式分别是:V______________;W______________;Y______________;Z______________。
某学生采用下面的装置及实验方法来测定推断乙醇的分子结构。
(1)该学生分别准备称取4.60 g乙醇进行多次实验,结果发现已排到量筒内的水的体积作为生成氢气的体积换算成标准状况下的体积都小于1.12 L。若忽略量筒本身及读数造成的误差,那么该学生认为是由于样品中含有少量水造成的,你认为正确吗?_________________(填“正确”或“不正确”)。如果你认为正确,请说明理由;你认为不正确,那么产生这种情况的原因应是什么?
____________________________________________________________。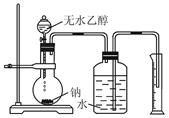
(2)该学生认为实验成功的关键有:
①装置气密性良好 ②实验开始前要准确确定乙醇的量 ③钠足量 ④广口瓶内必须充满水 ⑤氢气的体积测算方法正确、数据准确
你认为,其中正确的有_______________(填序号)。
(3)实验后,该学生从乙醇的可能结构分析入手,对乙醇和钠的关系进行讨论,若乙醇的物质的量为n mol,则对钠的物质的量取值要求必须是________________。
实验室用燃烧法测定某种氨基酸(CxHyOzNp)的分子组成。取W g 该种氨基酸放在纯氧中充分燃烧,生成CO2、H2O和N2。现按下图所示装置
进行实验:
回答下列有关问题:
(1)E装置的作用是___________________________________________________________。
(2)需要加热的装置是_________________________________________________________。
(3)写出氨基酸燃烧的方程式___________________________________________________。
(4)D的作用是_______________________________________________________________。
(5)F处读数时应注意的问题:_________________________________________________。
(6)还须测定的数据有_________________________________________________________。
紫杉醇是一种新型抗癌药,其分子式为C47H51NO14,它是由如下的A酸和B醇生成的一种酯。
B.R—OH(R是一个含C、H、O的基团)
(1)A可在无机酸催化下水解,其反应方程式是___________________________________。
(2)A水解所得的氨基酸不是天然蛋白质水解产物,因为氨基不在(填希腊字母)_______位。
(3)写出ROH的分子式:____________。
(12分)如图所示进行乙醇的催化氧化实验,试管A中盛有无水乙醇,玻璃管B中装有CuO(用石棉绒作载体)。请回答下列问题:
(1)向试管A中鼓入空气的目的是___________________________________________。
(2)试管A上部放置铜丝的作用是___________________________________________。
(3)玻璃管中可观察到的现象是_____________________________________;相关化学方程式是____________________________________________________________________。
(4)试管C中放的是蒸馏水,在实验过程中试管C导管口有气泡冒出,从液面逸出的气体的主要成分是__________________。