仅用下表提供的玻璃容器(非玻璃容器任选)就能实现相应实验目的的是
| 选项 |
实验目的 |
玻璃容器 |
| A |
分离乙醇和乙酸乙酯的混合物 |
分液漏斗、烧杯 |
| B |
用pH=1的盐酸配置100mL,pH=2的盐酸 |
100mL容量瓶、烧杯、玻璃棒、胶头滴管 |
| C |
用溴水、淀粉—KI溶液比较Br2与I2的氧化性强弱 |
试管、胶头滴管 |
| D |
用NH4Cl固体和Ca(OH)2固体制备并收集NH3 |
酒精灯、烧杯、导管、集气瓶 |
随着人们生活质量的不断提高,废电池必须进行集中处理的问题被提到议事日程上来,其主要的原因是()
| A.利用电池外壳的金属材料 | B.不使电池中渗泄的电解质溶液腐蚀其他物品 |
| C.防止电池中汞、镉和铅等重金属离子对土壤和水源的污染 | D.回收其中石墨电极 |
某温度、压强下,将一定量反应物通入密闭容器进行反应
SiCl4(g)+2H2(g) Si(s)+4HCl(g); ΔH=+QkJ/mol(Q>0),下列叙述正确的是 ( )
Si(s)+4HCl(g); ΔH=+QkJ/mol(Q>0),下列叙述正确的是 ( )
| A.反应过程中,若增大压强能提高SiCl4的转化率 |
| B.若反应开始时SiCl4为1 mol,则达平衡时,吸收热量为Q kJ |
| C.若单位时间内生成x molHCl的同时,生成x molH2,则反应达到平衡状态 |
| D.使用过量的H2或升高温度都可以提高SiCl4的转化率 |
下列说法中正确的是( )
A.凡是放热反应都是自发的,吸热反应都是非自发的
B.在反应A(g)+3B(g)=2C(g)+2D(g)的速率测定实验中,分别测得反应速率如下:v(A)= 0.15mol·L-1·s-1,
v (C)="0.3" mol·L-1·s-1,则用C来表示反应进行的速率更快。
C.如图所示,在一U型管中装入含有紫色石蕊试液的Na2SO4溶液,通直流电,一段时间后U型管内会形成一个倒立的三色“彩虹”,从左到右颜色的次序是:红、紫、蓝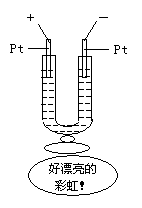
D.反应HCl(aq) + NaOH(aq) =" NaCl" (aq) + H2O(l)△H < 0, 在理论上能用于设计原电池。
已知:在100℃时,纯水的c(H+)为1×10—6,此时将pH=12的NaOH溶液V1 L与pH=l的H2SO4溶液V2 L混合,若所得混合溶液的pH=10,则V1∶V2为()
| A.1∶9 | B.10∶1 | C.9∶1 | D.1∶10 |
某温度下在密闭容器中发生如下反应:2M(g)+ N(g) 2E(g),若开始时只充入2 mol E气体,达到平衡时,混合气体的压强比起始增大了20%;若开始时只充入了3 mol M和1 mol N的混合气体,达到平衡时M的转化率为( )
2E(g),若开始时只充入2 mol E气体,达到平衡时,混合气体的压强比起始增大了20%;若开始时只充入了3 mol M和1 mol N的混合气体,达到平衡时M的转化率为( )
| A.<60% | B.=40% | C.<40% | D.>60% |