(2014届江西省景德镇市高三第一次模拟考试卷理综化学试卷)
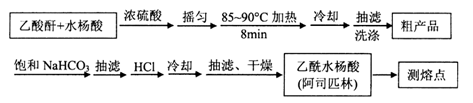
阿司匹林(乙酰水杨酸,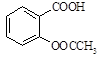 )是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下:
)是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下:
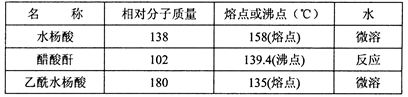
主要试剂和产品的物理常数
请根据以上信息回答下列问题:
(1)①合成阿斯匹林时,最合适的加热方式是 。
②抽滤所得粗产品要用少量冰水洗涤,则洗涤的具体操作是 。
(2)提纯粗产物中加入饱和NaHCO3溶液至没有CO2产生为止,再抽滤,则加饱和NaHCO3溶液的目的是 。
另一种改进的提纯方法,称为重结晶提纯法。方法如下:
(3)改进的提纯方法中加热回流的装置如图所示,
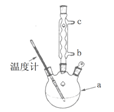
①使用温度计的目的是 。冷凝水的流进方向是 。(填“b”或“c”)。
②重结晶提纯法所得产品的有机杂质要比原方案少的原因 。
(4)检验产品中是否含有水杨酸的化学方法是 。
(5)该学习小组在实验中原料用量:2.0 g水杨酸、5.0 mL醋酸酐(ρ=1.08 g/cm3),最终称得产品m=2.2 g,则所得乙酰水杨酸的产率为 。
掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。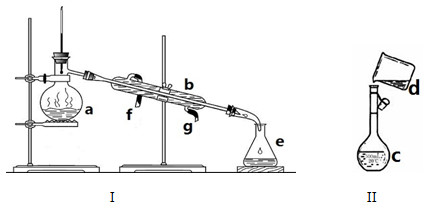
⑴写出下列仪器的名称:
a、b、c、
⑵仪器a~e中,使用前必须检查是否漏水的有(填字母)
⑶若利用装置I分离四氯化碳和酒精的混合物,还缺少的仪器是,将仪器补充完整后进行实验,温度计水银球的位置在处,冷凝水由(填f或g)口通入,由口流出。
(4)现需配制0.1mol/LNaOH溶液450mL,装置II是某同学转移溶液的示意图。
①图中的错误是,除了图中给出的的仪器和托盘天平、药匙外,为完成实验还必须使用的仪器有:;
②根据计算得知,所需NaOH的质量为g;
③配制时,其正确的操作顺序是(用字母表示,每个字母只能使用一次) ________
| A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶 |
| B.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解 |
| C.将溶解的氢氧化钠溶液沿玻璃棒注入500mL的容量瓶中 |
| D.将容量瓶盖紧,振荡,摇匀 |
E.改用胶头滴管加水,使溶液凹液面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1~2cm处
④若俯视容量瓶刻度,对所配制溶液浓度的影响是________(填“偏低”“偏高”或“无影响”)
(8分)食盐是日常生活的必需品,也是重要的化工原料。
粗食盐常含有少量K+、Ca2+、Fe3+、Mg2+、SO42-等杂质离子,实验室提纯NaCl的流程如下:
提供的试剂:饱和Na2CO3溶液饱和K2CO3溶液 NaOH溶液 BaCl2溶液
Ba(NO3)2溶液 75%乙醇四氯化碳
⑴欲除去溶液Ⅰ中的Ca2+、Mg2+、Fe3+、SO42-离子,选出a所代表的试剂,按滴加顺序依次为(只填化学式),写出除去Fe3+时所发生反应的离子方程式:________________________。
⑵操作Ⅲ的名称是_____________,所需用到的玻璃仪器有________________________。(填仪器名称)。
⑶洗涤NaCl晶体的目的是,选用的试剂为。
(9分)掌握仪器的名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。
⑴写出下列仪器的名称:①;②;④;
⑵仪器①~④中,使用时必须检查是否漏水的有(填序号)。
⑶若利用装置Ⅰ分离四氯化碳和酒精的混合物,还缺少的仪器有,将仪器补充完整后进行的实验操作的名称为;实验时仪器②中冷却水的进口为_________(选填“f”或“g”)。
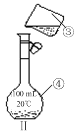
⑷现需配制250 mL 0.2 mol·L-1 NaCl溶液,装置Ⅱ是某同学转移溶液的示意图,图中的错误有。
某课外活动小组在实验室用下图的一些装置组合后,快速制取氨并验证氨的某些性质,同时收集少量纯净氮气,请回答: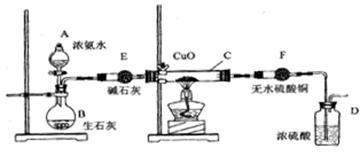
(1)写出用熟石灰和氯化铵反应制氨气的化学方程式
(2) 本实验进行一断时间后,观察到加热的硬质玻璃试管内黑色氧化铜粉末转为红色,盛无水硫酸铜的干燥管内出现蓝色,并且在最后的出气导管处收集到纯净、干燥的氮气。根据这些现象,写出在硬质玻璃试管内发生反应的化学方程式:,这个反应说明氨气具有____(填编号:A、碱性;B、还原性;C、氧化性; D、不稳定性)
(3) 洗气瓶中盛浓硫酸的主要作用是__________________
(4) 在最后的出气的导管口收集干燥、纯净的氮气,收集方法是:___________
(填编号:A、排气法 B、排水法 C、用气囊收集)
(5)装置E的作用是_______________。装置F验证的气体是___________。
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入25.00mL待测溶液到锥形瓶中;
②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;
③向锥形瓶中滴入酚酞作指示剂,进行滴定。滴定至终点,测得所耗盐酸的体积为V1mL;
④重复以上过程,但在滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL。
试回答下列问题:
(1)滴定终点时的现象为锥形瓶中的溶液由;
(2)滴定时边滴边摇动锥形瓶,眼睛应观察;
(3)该小组在步骤①中的错误是,由此造成的测定结果___________ (填偏高、偏低或无影响)
(4)步骤②缺少的操作是_______ ____
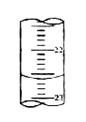
(5)右图,是某次滴定时的滴定管中的液面,其读数为___________mL;(上面数字:22,下面数字:23)。