已知:① Cu(s)+H2O2(l)+2H+ (aq)=Cu2+(aq)+2H2O(l) △H 1
②2H2O(l)=2H2(g)+O2(g) △H 2
③2H2O2(l)=2H2O(l)+O2 (g) △H 3
④Cu(s)+2H+ (aq)=Cu2+(aq)+H2 (g) △H4
则ΔH4的正确表达式为( )
A.△H4=△H 1+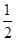 ×△H 2+ ×△H 2+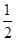 ×△H 3 ×△H 3 |
B.△H4=△H 1+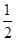 ×△H 2— ×△H 2—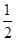 ×△H 3 ×△H 3 |
| C.△H4=△H 1+2×△H 2—2×△H 3 | D.△H4=2×△H 1+△H 2+△H 3 |
已知Ksp (AgCl)=1.8×10-10,Ksp(AgI)=1.0 ×10-16。下列关于难溶物之间转化的说法中错误的是
| A.AgCl难溶于水,不能转化为AgI |
| B.同一类型难溶物的Ksp相差越大,难溶物就越容易转化为更难溶的物质 |
| C.常温条件下,将饱和的AgCl溶液和AgI溶液等体积混合,会有沉淀生成 |
D.常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须大于(1/ )×10-11mol/L )×10-11mol/L |
常温下,下列溶液的pH或微粒的物质的量浓度关系正确的是
| A.某溶液中由水电离出的c(H+)=1×10-a mol·L-1,若a>7时,则该溶液的pH一定为14-a |
| B.将0.2mol•L-1的某一元酸HA溶液和0.1mol•L-1的NaOH溶液等体积混合后溶液的pH大于7,则反应后的混合液:c(OH-)+c(A-)=c(H+)+c(Na+) |
| C.等体积、等物质的量浓度的Na2CO3溶液与NaHCO3溶液混合:c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
| D.常温下NaHSO3溶液的pH<7,溶液中c(SO32-)<c(H2SO3) |
下列叙述正确的是
| A.将稀氨水逐滴加入稀硫酸中,当溶液的pH=7时,c(SO42-)>c(NH4+) |
| B.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色 |
| C.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2 |
| D.向0.1mol·L-1的氨水中加入少量硫酸铵固体,则溶液中c(OH-)/c(NH3·H2O)增大 |
下列各组中,每种电解质溶液电解时只生成氢气和氧气的是
| A.NaOH、H2SO4、 Ba(OH)2 | B.NaOH、CuSO4、 H2SO4 |
| C.HCl、 CuCl2、 Ba(OH)2 | D.NaBr、 H2SO4、 Ba(OH)2 |
向pH相等的一元酸HA和HB溶液中分别加入适量的锌粒,充分反应后,当收集到的H2的体积相等时,消耗酸的体积V(HA)>V(HB),下列分析正确的是
A.消耗锌的质量:HA>HB B.HA一定为强酸
C.生成H2的平均速率:v(HA)< v(HB) D.酸性:HB>HA