一定条件下,在体积为10 L的密闭容器中,1 mol X和1 mol Y进行反应:
2X(g)+Y(g) Z(g) △H<0,反应经60s达到平衡并生成0.3 mol Z,则下列说法中正确的是
Z(g) △H<0,反应经60s达到平衡并生成0.3 mol Z,则下列说法中正确的是
| A.以Y浓度变化表示的反应速率为0.0005 mol/(L·s) |
| B.其他条件不变,将容器体积扩大至20 L,则Z的平衡浓度变为原来的1/2 |
| C.其他条件不变,将容器体积缩小至5L,平衡正向移动,平衡常数增大 |
| D.其他条件不变,升高温度逆反应速率加快,正反应速率减慢 |
下列各图所示装置的气密性检查中,漏气的是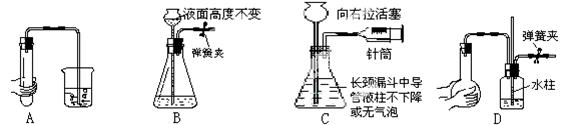
X、Y、Z、W是短周期元素,原子序数依次递增。X与Z位于同一主族,Y元素的单质既能与盐酸反应也能与NaOH溶液反应,Z原子的最外层电子数是次外层电子数的一半,Y、Z、W原子的最外层电子数之和为14。下列说法正确的是
| A.气态氢化物的稳定性:X<Z <W |
| B.Y的阳离子半径比W的阴离子半径小 |
| C.X、Z、W氧化物对应水化物酸性的强弱顺序为X<Z< W |
| D.室温下,含Y元素的盐形成的水溶液其pH<7 |
已知NaHSO4在水中的电离方程式为:NaHSO4=Na++H++SO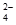 。某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2。下列对该溶液的叙述中,不正确的是
。某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2。下列对该溶液的叙述中,不正确的是
| A.该温度高于25℃ |
| B.由水电离出来的H+的浓度是1.0×10-10mol·L-1 |
| C.NaHSO4晶体的加入抑制了水的电离 |
| D.该温度下加入等体积pH为12的NaOH溶液可使该溶液恰好呈中性 |
用石墨电极电解CuCl2溶液(见下图)。下列分析正确的是
| A.通电使CuC12发生电离 |
| B.a端是直流电源的负极 |
| C.阳极上发生的反应:Cu2++2e- ="=" Cu |
| D.通电一段时间后,在阴极附近观察到黄绿色气体 |
下列离子方程式正确的是
| A.用CH3COOH溶解CaCO3: CaCO3+2H+=Ca2++H2O+C02↑ |
| B.Fe2(SO4)3和Ba(OH) 2溶液混合:Fe3++SO42-+Ba2++3OH-Fe(OH)3↓+ BaSO4↓ |
| C.硫酸工业尾气中的SO2用过量的氨水吸收:2NH3·H2O+ SO2 =2NH4++ SO32-+H2O |
| D.Cu溶于浓HNO3:Cu+ 4H++ 2NO3一=Cu2++ 2NO↑+ 4H2O |