下列离子方程式正确的是
| A.用CH3COOH溶解CaCO3: CaCO3+2H+=Ca2++H2O+C02↑ |
| B.Fe2(SO4)3和Ba(OH) 2溶液混合:Fe3++SO42-+Ba2++3OH-Fe(OH)3↓+ BaSO4↓ |
| C.硫酸工业尾气中的SO2用过量的氨水吸收:2NH3·H2O+ SO2 =2NH4++ SO32-+H2O |
| D.Cu溶于浓HNO3:Cu+ 4H++ 2NO3一=Cu2++ 2NO↑+ 4H2O |
通常人们把拆开1 mol某化学键所消耗的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应物的总键能与生成物的总键能之差。
| 化学键 |
Si—O |
Si—Cl |
H—H |
H—Cl |
Si—Si |
Si—C |
| 键能/kJ·mol-1 |
460 |
360 |
436 |
431 |
176 |
347 |
工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g) Si(s)+4HCl(g),该反应的反应
Si(s)+4HCl(g),该反应的反应 热△H为( )
热△H为( )
| A.+412 kJ·mol-1 | B.-412 kJ·mol-1 |
| C.+236 kJ·mol-1 | D.-236 kJ·mol-1 |
已知反应:
①25℃、101kP a时:N2H4(g)+O2(g)=N2(g)+2H2O(g);△H =-534 kJ·mol-1
a时:N2H4(g)+O2(g)=N2(g)+2H2O(g);△H =-534 kJ·mol-1
②稀溶液中:H+(aq)+OH-(aq)=H2O(l);△H=-57.3 kJ·mol-1
下列结论正确的是()
| A.N2H4的燃烧热大于534 kJ·mol-1 |
| B.①的反应热为221 kJ·mol-1 |
| C.稀硫酸与稀NaOH溶液反应的中和热为-57.3 kJ·mol-1 |
| D.稀醋酸与稀NaOH溶液反应生成l mol水,放出57.3 kJ热量 |
下列各组热化学方程式中Q1大于Q2(Q1、Q2为正值)的有()
①HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l);△H=-Q1kJ·mol-1
HAc(aq)+KOH(aq)=HAc(aq)+H2O;△H=-Q2kJ·mol-1
②C(s)+ O2(g)=CO(g);△H=-Q1kJ·mol-1
O2(g)=CO(g);△H=-Q1kJ·mol-1
C(s)+O2(g)=CO2(g);△H=-Q2kJ·mol-1
③4Al(s)+3O2(g)=2Al2O3(s);△H=-Q1kJ·mol-1
4Fe(s)+3O2(g)=2Fe2O3(s);△H=-Q2kJ·mol-1
④H2(g)+ O2(g)=H2O(g);△H=-Q1kJ·mol-1
O2(g)=H2O(g);△H=-Q1kJ·mol-1
H2(g)+ O2(g)=H2O(l);△H=-Q2kJ·mol-1
O2(g)=H2O(l);△H=-Q2kJ·mol-1
| A.①② | B.③④ | C.②④ | D.①③ |
下列反应的离子方程式正确的是()
A.向沸水中滴加FeCl3溶液制备Fe(OH)3胶体: |
| B.用小苏打治疗胃酸过多:HCO3-+H+=CO2↑+H2O |
C.实验室用浓盐酸与MnO2反应制Cl2: |
| D.用FeCl3溶液腐蚀印刷电路板:Fe3++Cu=Fe2++Cu2+ |
已知pH=1的某溶液中存在较多的Ba2+、NO3-,则该溶液中还可能大量存在的离子组是()
| A.Fe3+、F-、Cl- | B.Mg2+、SO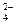 、Br- 、Br- |
| C.Mg2+、Cl-、Fe2+ | D.Na+、NH 、Cu2+ 、Cu2+ |