亚硝酸钠(NaNO2)易溶于水,微溶于乙醚,是常用的食品发色剂
(1)第一电离能:N ___O(填“<”、“>”或“=”);NO2-的空间构型为____
(2)亚硝酸钠在3200C会分解生成氧化钠、一氧化二氮等物质,该反应的化学方程式为____
(3)亚硝酸钠是亚硝酸的钠盐。HNO2的结构如图所示,则HNO2分子中有___个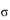 键:
键:
HNO2的酸性比HN03弱是因为_____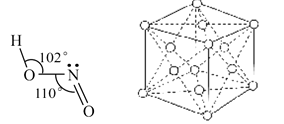
(4)亚硝基钻钠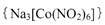 是钴的一种配合物,易溶于水,与钾离子反应生成淡黄色的
是钴的一种配合物,易溶于水,与钾离子反应生成淡黄色的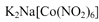 沉淀,可用于检验K+的存在。
沉淀,可用于检验K+的存在。
①基态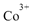 的价层电子排布图为_____
的价层电子排布图为_____
②用亚硝酸钻钠检验K+的离子方程式是
③金属钴的堆积方式如图所示,若一个钴原子的半径为r,,则晶胞的体积V(晶胞)=__
试用杂化轨道理论分析为什么BF3的空间构型是平面三角形,而NF3是三角锥形的?
1808年英国科学家道尔顿提出了近代原子学说,1811年意大利科学家阿伏加德罗提出了分子的概念,二十世纪奥地利和德国物理学家泡利、洪特分别提出了核外电子排布的“泡利不相容原理”、“洪特规则”,1869年俄国化学家门捷列夫发现了元素周期律,十九世纪荷兰物理学家范德华首先研究了分子间作用力。从此化学从“实验经验型”上升到对物质结构的理论探究。这对科学的发展有何重要意义?
在2400多年前,古希腊哲学家德谟克利特在一首诗中表达了物质不灭的观点:“无中不能生有,任何存在的东西也不会消灭。看起来万物是死了,但是实则犹生;正如一场春雨落地,霎时失去踪影;可是草木把它吸收,长成花叶果实,——依然欣欣向荣。”请你从分子和原子的观点,说明物质不灭的原因。
“法轮功”魔头李洪志在某次“带功”报告会上吹嘘,“一次我拿一根纯铝棒经意念发功后,经高能物理研究所测试,铝棒的成分都发生了变化,变成了铁,还有铜和金的成分……”试用化学的观点从能量和核变化的角度分析其荒谬之处。
有一种硬水和一种软水,请用家庭中常使用的物品检验之(两种方法)。