【化学一物质结构与性质】
根据物质结构与性质的关系,请回答下列问题:
(1)基态铬(Cr)原子的价电子排布式是________,这样排布使整个体系能量最低,原因是________。
(2)氨水中存在多种形式的氢键,其中与“氨极易溶于水”这种性质相关的氢键可表示为:_________。解释NH3分子中键角大于H2O中的键角的原因是_________ 。
(3)下列各项的比较中正确的是_________。
| A.第一电离能:Mg>Al | B.电负性:P>Ge |
| C.稳定性:AsH3>H2S | D.金属性: |
(4) Fe单质的晶体在不同温度下有两种堆积方式,晶胞
结构如图所示,体心立方晶胞和面心立方晶胞中实际含有的
Fe原子个数之比为_________。
高铁酸钾(K2FeO4)具有极强的氧化性,可作为水处理剂和高容量电池材料。
(1)FeO42-与水反应的方程式为:4FeO42-+ 10H2O 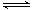 4Fe(OH)3 + 8OH-+ 3O2,
4Fe(OH)3 + 8OH-+ 3O2,
K2FeO4在处理水的过程中所起的作用是________。
(2)与MnO2-Zn电池类似,K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为____________________________。
(3)将适量K2FeO4配制成c(FeO42-)=1.0×10-3 mol/L(1.0mmol/L)的试样,FeO42-在水溶液中的存在形态如右图所示。下列说法正确的是(填字母)。
A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.改变溶液的pH,当溶液由pH=10降至pH=4的过程中,HFeO4-的分布分数先增大后减小
C.向pH=8的这种溶液中加KOH溶液,发生反应的离子方程式为:H2FeO4+OH-=HFeO4-+H2O
D.pH约为2.5 时,溶液中H3FeO4+和HFeO4-比例相当
(4)HFeO4-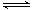 H++FeO42-的电离平衡常数表达式为K=______________,其数值接近_______(填字母)。
H++FeO42-的电离平衡常数表达式为K=______________,其数值接近_______(填字母)。
A.10-2.5B.10-6C.10-7D.10-10
(5)25℃时,CaFeO4的Ksp = 4.536×10-9,若要使100mL1.0×10-3 mol/L的K2FeO4溶液中的c(FeO42-)完全沉淀,则理论上需控制溶液中Ca2+浓度至少为__________。
I.下图为相互串联的三个装置,试回答:
(1)若利用乙池在铁片上镀银,则B是_________(填电极材料),电极反应式是_________;应选用的电解质溶液是_____________。
(2)若利用乙池进行粗铜的电解精炼,则________极(填“A”或“B”)是粗铜,若粗铜中还含有Au、Ag、Fe,它们在电解槽中的存在形式和位置为_____________________。
(3)丙池滴入少量酚酞试液,电解一段时间___________(填“C”或“Fe”)极附近呈红色。
(4)写出甲池负极的电极反应式:________________________________。若甲池消耗3.2gCH3OH气体,则丙池中阳极上放出的气体物质的量为______________。
II.(5)请利用反应Fe +2Fe3+= 3Fe2+设计原电池。
设计要求:①该装置尽可能提高化学能转化为电能的效率;
②材料及电解质溶液自选,在图中做必要标注;
③画出电子的转移方向。
(Ⅰ)A、B、C、D、E五种溶液分别为NaOH、NH3·H2O、CH3COOH、HCl、NH4HSO4中的一种。常温下进行下列实验:
①将1LpH=3的A溶液分别与0.001mol/L xLB溶液、0.001mol/L yLD溶液充分反应至中性,x、y大小关系为:y<x;
②浓度均为0.1mol/L A和E溶液,pH:A<E
③浓度均为0.1mol/L C与D溶液等体积混合,溶液呈酸性。
回答下列问题:
(1)D是_____________溶液
(2)用水稀释0.1mol/LB时,溶液中随着水量的增加而减小的是_____________(填写序号)
① ;②
;② ;③c(H+)和c(OH-)的乘积;④OH-的物质的量
;③c(H+)和c(OH-)的乘积;④OH-的物质的量
(3)OH-浓度相同的等体积的两份溶液A和E,分别和锌粉反应,若最后仅有一份溶液中存在锌,放出氢气的质量相同,则下列说法正确的是_____________(填写序号)
①反应所需要的时间E>A ②开始反应时的速率A>E
③参加反应的锌粉物质的量A=E④反应过程的平均速率E>A
⑤A溶液里有锌粉剩余⑥E溶液里有锌粉剩余
(4)将等体积、等物质的量浓度B和C混合后溶液,升高温度(溶质不会分解)溶液pH随温度变化如图中的_____________曲线(填写序号).
(5)室温下,向0.01mol/LC溶液中滴加0.01mol/LD溶液至中性,得到的溶液中所有离子的物质的量浓度由大到小的顺序为_____________.
(Ⅱ)如下图所示 ,横坐标为溶液的pH值,纵坐标为Zn2+离子或Zn(OH)42-离子物质的量浓度的对数,回答下列问题。
(1)往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为:_______________。
(2)从图中数据计算可得Zn(OH)2的溶度积(Ksp)=_______________。
(3)某废液中含Zn2+离子,为提取Zn2+离子可以控制溶液中pH值的范围是________________________。
氯气用途广泛,但在使用时,一般会产生氯化氢。工业上可用O2将HCl转化为Cl2,以提高效益,减少污染。反应为:
完成下列填空:
(1).该反应化学平衡常数K的表达式为 ;
实验测得P0压强下,HCl平衡转化率α(HCl)随反应温度T的变化如图所示,则正反应是 反应(填“吸热”或者“放热”)。
(2).上述实验中若压缩体积使压强由P0增大至P1,在图中画出P1压强下HCl平衡转化率α(HCl)随反应温度T变化的曲线,并简要说明理由: 。
(3).该反应在P0、320°C条件下进行,达平衡状态A时,测得容器内n(Cl2)=7.2×10–3mol,则此时容器中的n(HCl)= mol。
(4).对该反应达到平衡后,以下分析正确的是 (选填编号)。
a.增加n(HCl),对正反应的反应速率影响更大
b.体积不变加入稀有气体,对正反应的反应速率影响更大
c.压强不变加入稀有气体,对逆反应的反应速率影响更大
d.如果平衡常数K值增大,对逆反应的速率影响更大
(5).氯元素能形成多种离子。在水溶液中1molCl–、1mol ClOx–(x=1,2,3,4)能量的相对大小如图所示,写出B→A+C反应的热化学方程式(用离子符号表示) ;若有1.5molB发生反应,转移电子 mol。
【化学—选修2:化学与技术】水是一种重要的自然资源,是人类赖以生存不可缺少的物质。请回答下列问题:
(1)水质优劣直接影响人体健康。天然水在净化处理过程中加入的混凝剂可以是 _____________(填两种物质的名称),其净水作用的原理是_________________________。
(2)水的净化与软化的区别是____________________________________。
(3)硬度为1的水是指每升水含10 mg CaO或与之相当的物质(如7.1 mg MgO)。若某天然水中c(Ca2+)=1.2×10-3mol/L,c(Mg2+)=6×10-4mol/L,则此水的硬度为_______________。
(4)若(3)中的天然水还含有c(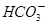 )=8×10-4mol/L,现要软化10m3这种天然水,则需先加入Ca(OH)2_________g,后加入Na2CO3___________g。
)=8×10-4mol/L,现要软化10m3这种天然水,则需先加入Ca(OH)2_________g,后加入Na2CO3___________g。
(5)如图是电渗析法淡化海水的原理图。其中,
电极A接直流电源的正极,电极B接直流电源的
负极。
①隔膜A是_________离子交换膜(填“阴”或
“阳”)。
②某种海水样品,经分析含有大量的Na+,Cl-,
以及少量的K+, 。若用上述装置对该海水进行淡化,当淡化工作完成后,A,B,C三室中所得溶液(或液体)的pH分别为pHa、pHb、pHc,则其大小顺序为____________。
。若用上述装置对该海水进行淡化,当淡化工作完成后,A,B,C三室中所得溶液(或液体)的pH分别为pHa、pHb、pHc,则其大小顺序为____________。