(14分)2013年初,雾霾天气多次肆虐天津、北京等地区。其中,燃煤和汽车尾气是
造成空气污染的原因之一。
(l)汽车尾气净化的主要原理为:2NO(g) + 2CO(g) 2CO2(g)+ N2(g)△H <0
2CO2(g)+ N2(g)△H <0
①该反应平衡常数表达式____________________________
②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是________________(填代号)。
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
已知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol ①
2NO2(g) N2O4(g) △H=-56.9 kJ/mol ②
N2O4(g) △H=-56.9 kJ/mol ②
H2O(g)=H2O(l) △H=-44.0 kJ/mol ③
写出CH4催化还原N2O4(g)生成N2和H2O(1)的热化学方程式:_____________________。
(3)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解100mLlmol/L食盐水,电解一段时间后,收集到标准状况下的氢气2.24L(设电解后溶液体积不变).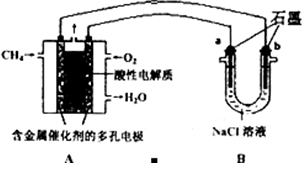
①甲烷燃料电池的负极反应式:______________________________________.
②电解后溶液的pH=____(忽略氯气与氢氧化钠溶液反应)
③阳极产生气体的体积在标准状况下是________L
在一个容积为2L的密闭容器中,加入0.8mol的A2气体和0.6molB2气体,一定条件下发生如下反应:A2(g)+B2(g) 2AB(g)△H<0,反应中各物质的浓度随时间的变化情况如图所示。
2AB(g)△H<0,反应中各物质的浓度随时间的变化情况如图所示。
(1)在上述反应达到平衡后,第4min时,若将容器的体积快速扩大一倍(其他条件不变),请在图中画出4min~5min的AB浓度的变化线。
(2)在相同条件下,若开始时向此容器中加入的A2(g)、B2(g)和AB(g)的物质的量分别为0.4mol、0.2mol、0.8mol。则反应向 反应方向进行(填“正”或“逆”)。判断依据是 。反应达到平衡后,各物质的体积分数与原平衡相比___________(填序号)
①A2、B2减小,AB增大 ②A2、B2增大,AB减小 ③均不变 ④无法确定
化学反应原理在合成氨工业及氨的性质研究中具有广泛的应用。
(1)工业生产硝酸的第一步反应是氨的催化氧化反应,已知下列3 个热化学方程式(K 为平衡常数):
(2)工业合成氨所用的氢气主要来自天然气与水的反应,但这种原料气中往往混有一氧化碳杂质,工业生产中通过如下反应来除去原料气中的CO:CO(g)+H2O(g) CO2(g)+ H2(g)ΔH<0。
CO2(g)+ H2(g)ΔH<0。
①一定条件下,反应达到平衡后,欲提高CO 的转化率,可采取的措施有 、 。
②在容积为2 L 的密闭容器中发生上述反应,其中c(CO)随反应时间(t)的变化如图甲中曲线Ⅰ,如果在t0时刻将容器容积扩大至4 L,请在图甲中画出t0时刻后c(CO)随反应时间(t)的变化曲线。

(3)氨气的重要用途是合成尿素,一定条件下,NH3和CO2 合成尿素的反应为 。当加料比例n(NH3)/n(CO2)="4" 时,CO2的转化率随反应时间(t)的变化如图乙所示,a 点v 逆(CO2) b 点v 正(CO2)(填“>”、“<”或“=”),NH3的平衡转化率为 。
。当加料比例n(NH3)/n(CO2)="4" 时,CO2的转化率随反应时间(t)的变化如图乙所示,a 点v 逆(CO2) b 点v 正(CO2)(填“>”、“<”或“=”),NH3的平衡转化率为 。
(4)硫酸工业生产过程中产生的尾气可用氨水吸收,生成的(NH4)2SO3再与硫酸反应,将生成的SO2返回车间作生产硫酸的原料,而生成的(NH4)2SO4可作肥料。常温下,0.1mol·L-1(NH4)2SO4溶液中各离子浓度由大到小的顺序是 ;
若某工厂中使用的是室温下0.1 mol·L-1的氨水,那么该氨水的pH= 。
(已知
近年来,铝在汽车、航天、机械制造、军事等产业中应用迅猛发展。
(1)铝元素的离子结构示意图为 ;工业上,用冰晶石作助熔剂、石墨作电极电解熔融氧化铝制铝,请写出电解反应方程式 ;在电解过程中 极(填“阴”或“阳”)需要定期补充。
(2)铍(Be)与铝元素相似,其氧化物及氢氧化物具有两性
①请写出Be(OH)2溶于NaOH溶液的化学方程式为: ;
②往10.0mL1.00 mol/L的Be(NO3)2溶液中逐滴加入等浓度的NaOH溶液,请在以下坐标图中画出沉淀量随NaOH溶液加入量的变化图:
高铁酸钠是一种高效多功能水处理剂。工业上常采用NaClO氧化法生产,反应原理为:在碱性条件下,利用NaClO氧化Fe(NO3)3制得Na2FeO4,过滤得到粗产品,再用NaOH溶液溶解,重结晶,用有机溶剂脱碱,低温烘干得到固体样品。反应方程式为:
3NaClO + 2Fe(NO3)3 + 10NaOH=2Na2FeO4↓+ 3NaCl + 6NaNO3 + 5H2O
(1)上述制备过程中,用NaOH溶液溶解粗产品而不用水的原因是 。
(2)高铁酸钠电池是一种新型可充电电池,电解质为NaOH溶液,放电时负极材料为Zn,正极产生红褐色沉淀,写出该电池反应方程式 。
(3)生产高铁酸钠的原料之一Fe(NO3)3用黑色粉末Fe(含有Fe3O4)与稀硝酸反应制备。准确称取该黑色粉末13.12g,加入200mL 4 mol·L-1 HNO3搅拌,固体完全溶解,共收集到标准状况下2688mL的气体,经分析其中只含有NO,并测得此时溶液中c(H+)=0.4mol·L-1(设反应前后溶液体积不变)。通过以上数据,计算该黑色粉末中Fe的质量分数。(写出计算过程,结果保留两位小数)
;请写出己烷(C6H14)的同分异构体的结构简式。