在一个容积为2L的密闭容器中,加入0.8mol的A2气体和0.6molB2气体,一定条件下发生如下反应:A2(g)+B2(g) 2AB(g)△H<0,反应中各物质的浓度随时间的变化情况如图所示。
2AB(g)△H<0,反应中各物质的浓度随时间的变化情况如图所示。

(1)在上述反应达到平衡后,第4min时,若将容器的体积快速扩大一倍(其他条件不变),请在图中画出4min~5min的AB浓度的变化线。
(2)在相同条件下,若开始时向此容器中加入的A2(g)、B2(g)和AB(g)的物质的量分别为0.4mol、0.2mol、0.8mol。则反应向 反应方向进行(填“正”或“逆”)。判断依据是 。反应达到平衡后,各物质的体积分数与原平衡相比___________(填序号)
①A2、B2减小,AB增大 ②A2、B2增大,AB减小 ③均不变 ④无法确定
海水是宝贵的资源宝库,目前氯碱工业、海水提镁、海水提溴为人类提供了大量工业原料。下图是海水综合利用的部分流程图,据图回答问题: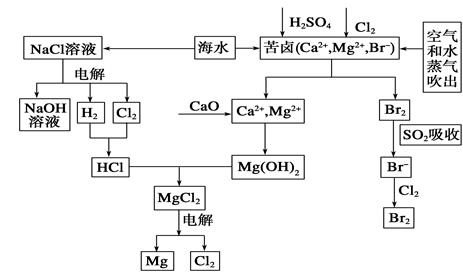
(1)由海水晒制的粗盐中含有Ca2+、Mg2+、SO42-等离子,为除去这些离子,所加试剂及其先后顺序为(写化学式)_________________________。
(2)①目前较先进的电解制碱法是离子交换膜电解法,即用阳离子交换膜把电解槽隔成阴极室和阳极室,其作用是____________________,电解饱和食盐水的化学反应方程式为___________________。
②制取MgCl2的过程中涉及反应:MgCl2·6H2O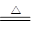 MgCl2+6H2O,该反应要在HCl气氛中进行,原因是__________。
MgCl2+6H2O,该反应要在HCl气氛中进行,原因是__________。
(3)苦卤中通入Cl2已经置换出Br2,为什么吹出后用SO2吸收转化为Br-再用Cl2置换______________,由此判断Cl2、Br2、SO2的氧化性由强到弱的顺序为________。
(4)也有工艺是在吹出Br2后用碳酸钠溶液吸收,形成溴化钠和溴酸钠,同时有CO2放出。该反应的离子方程式是_________________;最后再用H2SO4处理得到Br2,该反应的离子方程式是__________________。
(9分)金刚烷是一种重要的化工原料,工业上可通过下列途径制备:
(1)环戊二烯分子中最多有个原子共平面;
(2)金刚烷的分子式为,其分子中的-CH2-基团有个;
(3)下面是以环戊烷为原料制备环戊二烯的合成路线:
其中,反应①的产物名称是, 反应②的反应试剂和反应条件,反应④的反应类型是;
(4)已知烯烃能发生反应:
请写出下列反应产物的结构简式: 。
。
有机化学反应因反应条件不同,可生成不同的有机产品。例如: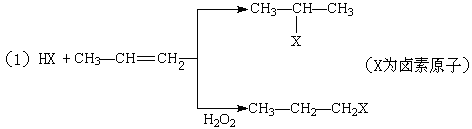
(2)苯的同系物与卤素单质混合,若在光照条件下,侧链上氢原子被卤素原子取代;若在催化剂作用下,苯环上的氢原子被卤素原子取代。
工业上利用上述信息,按下列路线合成结构简式为 的物质,该物质是一种香料。
的物质,该物质是一种香料。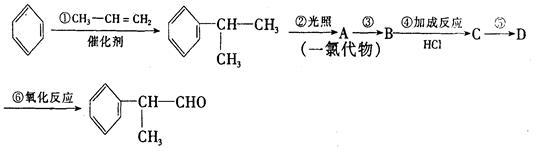
请根据上述路线,回答下列问题:
(1)A的结构简式可能为____________________________________。
(2)反应①、⑤的反应类型分别为________、_______。
(3)反应④的化学方程式为(有机物写结构简式,并注明反应条件):_______________________。
(4)工业生产中,中间产物A须经反应③④⑤得D,而不采取直接转化为D的方法,其原因是______________________________。
(5)这种香料具有多种同分异构体,其中某些物质有下列特征:①其水溶液遇FeCl3溶液呈紫色②分子中有苯环,且苯环上的一溴代物有两种。写出符合上述条件的物质可能的结构简式(只写三种):
______________________________。
下表是元素周期表的一部分,请针对表中所列标号为①~⑩的元素回答下列问题。
(1)非金属性最强的元素是______(填元素符号,下同),形成化合物种类最多的元素是____________。
(2)第三周期元素除⑩外原子半径最小的是______(填元素符号),这些元素的最高价氧化物对应水化物中碱性最强的是__________(填化学式,下同),具有两性的是____________。
(3)⑤⑥⑦单质的活泼性顺序为______>______>______(填元素符号),判断的实验依据是_______(写出一种)。
在原子序数1—18号元素中,按要求用合适的化学用语填空
(1)与水反应最剧烈的金属是_____________。
(2)与水反应最剧烈的非金属单质是_____________。
(3)原子半径最小的元素是_____________。
(4)气态氢化物最稳定的化学式是_____________。
(5)最高价氧化物对应水化物的酸性最强的化学式是_____________。
(6)电子数为10的分子(写5个)