天然水是人类饮用水的主要来源。从天然水获得可以饮用的水一般须经过沉降悬浮物、杀菌消毒等步骤。
(1)沉降悬浮物要在水中加入絮凝剂,如将铝盐加入水中能达到净水目的,
原因是 (用离子方程式表示)。
(2)氯气可用于自来水杀菌消毒剂,结合离子方程式和文字理由 。
(3)新型水处理剂高铁酸钾 (K2FeO4)具有强的氧化作用和絮凝作用。工业上可通过以下流程制备高铁酸钾: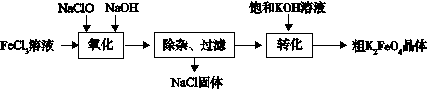
查阅资料:高铁酸盐在中性或酸性溶液中会逐渐分解,在碱性溶液中稳定。
完成“氧化”过程中的离子方程式
□Fe3+ + □ClO- +□ ="□" FeO42- + □Cl- + □
“转化”过程中实现由Na2FeO4制得K2FeO4,是利用二者 性的不同。
③结合资料完成粗K2FeO4晶体的提纯:将粗产品用 溶解,然后再加入饱和KOH溶液、冷却结晶、过滤。
④高铁酸钾的应用还在不断扩展中。如可制成高铁电池, 电池反应为:
3Zn + 2K2FeO4 + 8H2O  3Zn(OH)2 + 2Fe(OH)3 + 4KOH
3Zn(OH)2 + 2Fe(OH)3 + 4KOH
放电时,正极反应为: 。
某课外活动小组用如图装置进行实验,试回答下列问题:
(1)若开始时开关K与a连接,则B极的电极反应为 。
(2)若开始时开关K与b连接,则B极的电极反应为 ,总反应的离子方程式为 。
(3)有关上述实验,下列说法正确的是 。
| A.溶液中Na+向A极移动 |
| B.从A极处逸出的气体能使湿润的KI淀粉试纸变蓝 |
| C.反应一段时间后加适量盐酸可恢复到电解前电解质的浓度 |
| D.若标准状况下B极产生2.24 L气体,则溶液中转移0.2 mol电子 |
(4)该小组同学认为,如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
①该电解槽的阳极反应为 。 此时通过阴离子交换膜的离子数 (填“大于”“小于”或“等于”)通过阳离子交换膜的离子数。
②制得的氢氧化钾溶液从出口(填“A”、“B”、“C”或 “D”)________导出。
③电解过程中阴极区碱性明显增强,用平衡移动原理解释原因__________________________
氯气是一种重要的化工原料,自来水的消毒、农药的生产、药物的合成都需要用氯气.
I.工业上通常采用电解法制氯气:观察图1,回答:
(1)电解反应的化学方程式为 .
(2)若饱和食盐水中通电后,b侧产生的气体检验方法是 。
Ⅱ.某学生设计如图2所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),回答下列问题:
(1)在A装置中用固体二氧化锰与浓盐酸,在加热条件下制取氯气,写出反应的化学方程式 ;若在标准状态下收集到22.4升的氯气,则被氧化的HCl的物质的量是 mol.
(2)漂白粉将在U形管中产生,其化学方程式是 .
(3)C装置的作用是
(4)此实验所得漂白粉的有效成分偏低,该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应.①温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,可采取的措施是 。②试判断另一个副反应(用化学方程式表示) 。
为避免此副反应的发生,可将装置做何改进 。
实验室需要0.1 mol/L NaOH溶液450 mL和0.5 mol/L硫酸溶液450 mL.根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是 (填序号),仪器E的名称是 ,本实验所需玻璃仪器E规格为 mL。
(2)下列操作中,容量瓶所不具备的功能有 (填序号)。
| A.配制一定体积准确浓度的标准溶液 | B.长期贮存溶液 |
| C.用来加热溶解固体溶质 | D.量取一定体积的液体 |
(3)根据计算得知,所需质量分数为98%、密度为1.84 g/cm3的浓硫酸的体积为 mL
(计算结果保留一位小数)。如果实验室有10 mL、25mL、50 mL量筒,应选用 mL规格的量筒最好。
某化学兴趣小组的同学进行草酸亚铁晶体(FeC2O4·nH2O)分解的实验探究。经小组讨论,他们设计了如下装置进行实验。烧瓶B中盛有饱和NH4Cl和饱和NaNO2混合液(常用于实验室制N2),干燥管C1、C4中装有碱石灰,试管E1、E3、E4中装有澄清石灰水。
(1)充分反应后,将D1中的固体残余物投入足量经煮沸的稀硫酸中,固体完全溶解且无气体放出,取反应液加入KSCN溶液无血红色,证明固体产物为 。
(2)该实验装置中有3个酒精灯,至少应该点 次酒精灯,最先点燃的酒精灯是 ,最后点燃的是 。
(3)该实验装置中有4个直立的试管,它们与盛放试剂体现不同的作用,其中E2的作用是: 。
(4)该实验装置中有4个干燥管,C3中盛装的试剂是 。
(5)取7.2 g样品充分反应后,测得D1中的固体残余物为2.88 g,D2中固体质量减轻0.64 g,则草酸亚铁晶体(FeC2O4·nH2O)分解的方程式为 。
某化学学习小组发现在碱性溶液中,NO2会发生如下反应: 2NO2 + 2NaOH = NaNO2 + NaNO3 + H2O
2NO2 + 2NaOH = NaNO2 + NaNO3 + H2O
2NO2 + Na2CO3 = NaNO2 + NaNO3 + CO2
于是提出猜想,NO2和碱性的NaHCO3溶液也能发生类似反应。该小组利用如图所示装置,使NO2和NaHCO3溶液充分反应后,获得溶液X。
(1)Cu与浓硝酸反应的现象是_______________________。
(2)该小组同学为了对猜想进行探究,进行如下讨论和实验。
①甲同学认为,可通过检验X中是否存在NO3—的方法验证猜想。但经讨论后认为不可行,你认为其原因是 。
②乙同学在X中加入少量K2Cr2O7溶液,结果溶液褪色,则证明X中含有NaNO2。根据以上信息,写出NO2与NaHCO3溶液反应的离子方程式_________________ 。
(3)已知在酸性条件下NO2— 能将I— 氧化为I2。你认为能否用KI淀粉溶液检验X中存在NaNO2: ___________(填“能”或“不能”),原因是____________________________。
(4)已知5NO2— + 2MnO4—+6H+= 5NO3—+ 2Mn2+ +3H2O。称取a g KMnO4固体,加蒸馏水和少量稀硫酸溶解,配成250 mL溶液。移取20.00mL X于锥形瓶,用所配的酸性KMnO4溶液进行滴定,消耗b mL KMnO4溶液。滴点终点的现象是 ,则X中NaNO2的浓度是______________(用含a、b的式子表示)。