a、b、c、d、e五种短周期主族元素,在元素周期表中的相对位置如下表。b与d可以形成两种常见的化合物,下列说法错误的是
| |
|
a |
b |
|
| c |
|
|
d |
e |
A.元素c的氧化物具有两性
B.原子半径的大小顺序为:a>b>c>d>e
C.b元素在地壳中的含量居第一位
D.元素d的非金属性小于e
向18.4 g铁和铜组成的合金中加入过量的硝酸溶液,合金完全溶解,同时生成NO2、NO混合气体,再向所得溶液中加入足量的NaOH溶液,生成30.3 g沉淀。另取等质量的合金,使其与一定量的Cl2恰好完全反应,则Cl2 的体积在标准状况下为()
| A.7.84L | B.6.72L | C.4.48L | D.无法计算 |
中学化学中,常见无机物A、B、C、D、E、X、Y存在如下图转化关系(部分生成物和反应条件略去)。下列推断正确的是()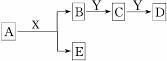
A.若A是CaC2,X是H2O,则Y一定是溴水
B.若A是金属钠,X是H2O,则E一定能还原Fe2O3
C.若Y是NaOH,C是白色沉淀,则A与X一定发生置换反应
D.若Y是氧气,D是氧化物,则A与X一定发生氧化还原反应
X、Y、Z、W均为短周期元素,且原子序数依次增大。X原子的核外只有一个电子,Y 的单质是空气的主要成分,Z原子最外层电子数是其周期数的三倍,W与X位于同一主族。下列叙述正确的是()
| A.工业上常电解熔融的Z与W组成的化合物以得到单质W |
| B.Y、Z、W形成的化合物的水溶液一定呈中性 |
| C.X与Y、X与Z都可以形成18电子的化合物 |
| D.X、Y、Z形成的化合物一定只含有共价键 |
下列参数比较及解释均正确的是()
| 选项 |
参数 |
比较 |
解释 |
| A |
还原性 |
Br->Cl- |
元素的非金属性越强,简单阴离子的还原性越弱 |
| B |
半径 |
Na+<Mg2+<Al3+ |
同一周期粒子半径随原子序数的递增逐渐减小 |
| C |
酸性 |
H2SO3>H2CO3 |
元素的非金属性越强,其含氧酸的酸性越强 |
| D |
沸点 |
HF<HCl<HI |
组成结构相似的物质,相对分子质量越大沸点越高 |
下列叙述错误的是()
①热稳定性:H2O>HF>H2S
②密度:K<Na<Rb
③第ⅠA、ⅡA族元素的阳离子与同周期稀有气体元素的原子具有相同的核外电子排布
④HCl的形成过程: +
+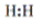 →
→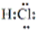
⑤元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素
⑥结合质子的能力:S2->Cl-
⑦因为常温下白磷可自燃,而氮气须在放电时才与氧气反应,所以非金属性:P>N
A.①②④⑤ B.③⑤⑥⑦ C.②④⑤⑥ D.①③④⑦