碳、氮和铝的单质及其化合物在工农业生产和生活中有重要的作用。
(1)真空碳热还原—氯化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
2Al2O3(s)+2AlCl3(g)+6C(s)=6AlCl(g)+6CO(g) △H=a kJ·mol-1
3AlCl(g) =2Al(l)+AlCl3(g) △H=b kJ·mol-1
反应Al2O3(s)+3C(s)=2Al(l)+3CO(g)的△H= kJ·mol-1(用含a、b的代数式表示);
(2)用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g) N2(g)+CO2(g) △H="Q" kJ·mol-1在T1℃时,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g) △H="Q" kJ·mol-1在T1℃时,反应进行到不同时间测得各物质的浓度如下:
| 时间(mol/L) 浓度(mol/L) |
0 |
10 |
20 |
30 |
40 |
50 |
| NO |
1.00 |
0.68 |
0.50 |
0.50 |
0.60 |
0.60 |
| N2 |
0 |
0.16 |
0.25 |
0.25 |
0.30 |
0.30 |
| CO2 |
0 |
0.16 |
0.25 |
0.25 |
0.30 |
0.30 |
①0~10min内,NO的平均反应速率v(NO)= ,T1℃时,该反应的平衡常数K= ;
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是 (填字母编号)。
a.通入一定量的NO b.加入一定量的活性炭
c.加入合适的催化剂 d.适当缩小容器的体积
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为3:1:1,则Q 0(填“>”或“<”)。
④在恒容条件下,能判断该反应一定达到化学平衡状态的依据是 (填选项编号)。
a.单位时间内生成2n mol NO(g)的同时消耗n mol CO2(g)
b.反应体系的温度不再发生改变
c.混合气体的密度不再发生改变
d.反应体系的压强不再发生改变
(3)铝电池性能优越,Al—Ag2O电池可用作水下动力电源,其原理如下图所示:
请写出该电池正极反应式 ;常温下,用该化学电源和惰性电极电解300ml硫酸铜溶液(过量),消耗27mg Al,则电解后溶液的pH= (不考虑溶液体积的变化)。
制纯碱包括石灰石分解、粗盐水精制、氨盐水碳酸化等基本步骤。完成下列计算:
(1)CaCO3质量分数为0.90的石灰石100kg完成分解产生CO2 L(标准状况下)。
(2)石灰窑中,该石灰石100kg与焦炭混合焙烧,产生CO2 29120L(标准状况下),如果石灰石中碳酸钙完全分解,且焦炭完全燃烧,不产生CO,则焦炭的物质的量为 mol。
(3)已知粗盐水含MgCl2 6.80mol/m3,含CaCl2 3.00mol/m3。向粗盐水中加入Ca(OH)2除镁离子:MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2,然后加入Na2CO3除钙离子。处理上述粗盐水10m3,至少需要加Na2CO3 g。
(4)如果用碳酸化尾气(含NH3体积分数为0.100、CO2体积分数0.040)代替碳酸钠,发生如下反应:Ca2++2NH3+CO2+H2O=CaCO3↓+2NH4+。处理上述10m3粗盐水至少需要通入 L(标准状况下)碳酸化尾气。
将等物质的量A、B混合于2L的密闭容器中,发生如下反应:3A(g)+ B(g)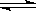 xC(g) + 2D(g),经5min后测得D的浓度为0.5mol/L,c (A)∶c(B)=3∶5,C的平均反应速率是0.1mol/(L·min)。
xC(g) + 2D(g),经5min后测得D的浓度为0.5mol/L,c (A)∶c(B)=3∶5,C的平均反应速率是0.1mol/(L·min)。
求:
(1)此时A的浓度及反应开始前放入容器中A、B物质的量;
(2)B的平均反应速率;
(3)x值是多少?
现有一种泉水,取0.5 L这种泉水作为样品,经测定该样品中含有48.00 mg的Mg2+。那么,该泉水中Mg2+的物质的量的浓度是多少?为使该泉水样品所含的Mg2+全部沉淀,应加入1 mol/L NaOH溶液的体积是多少?(请写出简要计算过程)
取7.8克的过氧化钠投入水中,完全反应后,所得溶液的体积为1L,问(1)生成的气体体积在标准状态下为多少升?(2)所得溶液溶质的物质的量浓度是多少?(要求写出计算过程)
在标准状况下,11.2LCO和CO2混合气体质量为20.4g,求混合气体中CO和CO2的体积比和质量比。