火电厂排放气体中含有二氧化硫、氮氧化物等大气污染物,大气污染物的研究治理对改善环境具有重要意义。
(1)煤燃烧产生的烟气(含有氮氧化物、SO2、PM2.5等),直接排放到空气中,引发的主要环境问题有 (填写字母编号)
A水体富营养化 B重金属污染 C雾霾 D酸雨
(2)将含有SO2的废气通过装有石灰石浆液的脱硫装置可以除去其中的二氧化硫,在废气脱硫的过程中,所用的石灰石浆液在进入脱硫装置前,需通一段时间的二氧化碳,以增加其脱硫效率;脱硫时控制浆液的pH值,此时浆液含有的亚硫酸氢钙可以被氧气快速氧化生成硫酸钙。写出亚硫酸氢钙被足量氧气氧化生成硫酸钙的化学方程式 。
(3)有人提出了一种利用氯碱工业产品治理含二氧化硫废气的方法,工艺流程如下:
A的化学式 ,若生成ag A,理论上可以回收SO2的质量为 g。
(4)汽车尾气中含有的氮氧化物(NOx)能形成酸雨,写出NO2转化为HNO3的化学方程式 。当尾气中空气不足时,NOX在催化转化器中被还原成N2排出,写出NO被CO还原的化学方程式 。
(5)工业上常用Na2CO3溶液处理煤燃烧产生的烟气,写出SO2、NO与Na2CO3溶液反应生成Na2SO4、N2的离子方程式 。
(届河北省唐山市高三4月第二次模拟理综化学试卷)
5种固体物质A、B、C、D、E由下表中不同的阴阳离子组成,它们均易溶于水。
| 阳离子 |
Na+ Al3+Fe3+ Cu2+、 Ba2+ |
| 阴离子 |
OH- Cl- CO32- NO3- SO4- |
分别取它们的水溶液进行实验,结果如下:
①A溶液与C溶液混合后产生蓝色沉淀,向该沉淀中加入足量稀HNO3,沉淀部分溶解,剩余白色固体;
②B溶液与E溶液混合后产生红褐色沉淀,同时产生大量气体;
③少量C溶液与D溶液混合后产生白色沉淀,过量C溶液与D溶液混合后无现象;
④B溶液与D溶液混合后无现象;
⑤将38.4 g Cu片投入装有足量D溶液的试管中,Cu片不溶解,再滴加1.6 mol·L-1稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现。
(1)据此推断A、C的化学式为:A;C。
(2)写出步骤②中发生反应的化学方程式。
(3)D溶液中滴入石蕊试液,现象是,
原因是(用离子方程式说明)。
(4)步骤⑤中若要将Cu片完全溶解,至少加入稀H2SO4的体积是mL。
(5)现用500 mL 3 mol·L-1的E溶液充分吸收11.2 L CO2气体(标准状况 下),反应后溶液中各离子的物质量浓度由小到大的顺序为。
(6)若用惰性电极电解A和B的混合溶液,溶质的物质的量均为0.1 mol,请在坐标系中画出通电后阳极产生气体的体积(标准状况下)V与通过电子的物质的量n的关系(不考虑气体溶于水)。 ’
’
(届江西省景德镇市高三第一次模拟考试卷理综化学试卷)
某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5 的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。
的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。
请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。
若测得该试样所含离子的化学组分及其浓度如下表:
| 离子 |
H+ |
K+ |
Na+ |
NH4+ |
SO42- |
NO3- |
Cl- |
| 浓度/mol·L-1 |
未测定 |
4×10-6 |
6×10-6 |
2×10-5 |
4×10-5 |
3×10-5 |
2×10-5 |
根据表中数据判断试样的pH=。
(2)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。
已知:H2(g)+1/2O2(g)=H2O(g) △H=-241.8kJ·mol-1
C(s)+1/2O2(g)="CO" (g)△H=-110.5kJ·mol-1
写出焦炭与水蒸气反应的热化学方程式: 。
②洗涤含SO2的烟气。以下物质可作洗涤剂的是。
A.Ca(OH) 2 B.Na2CO3 C.CaCl2D.NaHSO3
(3)汽车尾气中有NOx和CO的生成及转化
① 若1mol空气含0.8molN2和0.2molO2,汽缸中的化学反应式为N2 (g)+O2(g) 2NO(g)△H
2NO(g)△H 0
0
1300℃时将1mol空气放在密闭容器内反应达到平衡,测得NO为8×10-4mol。计算该温度下的平衡常数K=。
汽车启动后,汽缸温度越高,单位时间内NO排放量越大,其原因是。
②目前,在汽车尾气系统中装置催化转化器可减少CO和NOx的污染,其化学反应方程式为 。
③ 汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO,2CO(g)=2C(s)+O2(g)
已知该反应的△H 0,判断该设想能否实现并简述其依据:。
0,判断该设想能否实现并简述其依据:。
(届河南省商丘市高三第二次模拟考试理综化学试卷)
电镀厂镀铜废水中含有CN-和Cr2O72-离子,需要处理达标后才能排放。该厂拟定下列流程进行废水处理, 回答下列问题: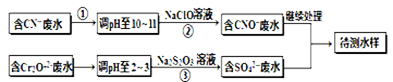
(1)上述处理废水流程中主要使用的方法是。
(2)②中反应后无气体放出,该反应的离子方程式为。
(3)步骤③中,每处理0.4mol Cr2O72-时转移电子2.4mol,该反应离子方程式为。
(4)取少量待测水样于试管中,加入NaOH溶液,观察到有蓝色沉淀生成,再加Na2S溶液, 蓝色沉淀转化成黑色沉淀,请使用化学用语和文字解释产生该现象的原因。
(5)目前处理酸性Cr2O72-废水多采用铁氧磁体法。该法是向废水中加入FeSO4·7H2O将Cr2O72-还原成Cr3+,调节pH,Fe、Cr转化成相当于 (铁氧磁体,罗马数字表示元素价态)的沉淀。处理1mol Cr2O72-,需加入a mol FeSO4•7H2O,下列结论正确的是。
(铁氧磁体,罗马数字表示元素价态)的沉淀。处理1mol Cr2O72-,需加入a mol FeSO4•7H2O,下列结论正确的是。
| A.x ="0.5" ,a =8 | B.x ="0.5" ,a = 10 | C.x =" 1.5" ,a =8 | D.x =" 1.5" ,a = 10 |
氨在国民经济中占有重要地位。
(1)合成氨工业中,合成塔中每产生2 mol NH3,放出92.2 kJ热量。
① 工业合成氨的热化学方程式是 。
② 若起始时向容器内放入2 mol N2和6 mol H2,达平衡后放出的热量为Q,则
Q(填“>”、“<”或“=”)_______184.4 kJ。
③ 已知:
1 mol N-H键断裂吸收的能量约等于_______kJ。
(2)工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:2NH3 (g)+ CO2 (g)  CO(NH2)2 (l) + H2O (l),该反应的平衡常数和温度关系如下:
CO(NH2)2 (l) + H2O (l),该反应的平衡常数和温度关系如下:
| T / ℃ |
165 |
175 |
185 |
195 |
| K |
111.9 |
74.1 |
50.6 |
34.8 |
①焓变ΔH(填“>”、“<”或“=”) 0
②在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)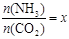 ,下图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是 。
,下图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是 。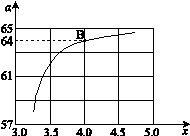
③ 上图中的B点处,NH3的平衡转化率为_______。
(3)氮气是制备含氮化合物的一种重要物质,而氮的化合物用途广泛。
下面是利用氮气制备含氮化合物的一种途径:
①过程Ⅱ的化学方程式是
②运输时,严禁NH3与卤素(如Cl2)混装运输。若二者接触时剧烈反应产生白烟,并且0.4 mol NH3参加反应时有0.3 mol 电子转移。写出反应的化学方程式
③氨是一种潜在的清洁能源,可用作碱性燃料电池的燃料。
已知:4NH3(g) + 3O2(g) = 2N2(g) + 6H2O(g) ΔH =" ―1316" kJ/mol,则该燃料电池的负极反应式是 。
氮元素可形成叠氮化物及络合物等。
(1)氢叠氮酸(HN3)是一种弱酸,它的酸性类似于醋酸,微弱电离出H+和N3-。
①写出与N3-互为等电子体的分子: ,N3-的空间构型是 型。
②叠氮化物、氰化物能与Fe3+及Cu2+及Co3+等形成络合物,如:[Co (N3)(NH3)5]SO4、Fe(CN)64-。写出钴原子在基态时的价电子排布式: 。CN-中C原子的杂化类型是 。
(2)由叠氮化钠(NaN3)热分解可得纯N2:2NaN3(s)=2Na(l)+3N2(g),有关说法正确的是 (选填序号)
| A.NaN3与KN3结构类似,前者晶格能较小 |
| B.第一电离能(I1):N>P>S |
| C.钠晶胞结构如图,该晶胞分摊2个钠原子 |
| D.氮气常温下很稳定,是因为氮的电负性小 |

(3)对氨基苯酚( )的沸点高于邻氨基苯酚(
)的沸点高于邻氨基苯酚(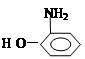 )的沸点(填:“大于”、“小于”、“等于”),理由是
)的沸点(填:“大于”、“小于”、“等于”),理由是