(7 分)由于大量使用一次性塑料方便袋造成的“白色污染”,已成为一个严重的社会问题。某化学研究小组的同学欲对某种塑料袋的组成进行分析研究,测定样品中元素的质量比,设计了如图所示的实验装置。
(小资料:该种塑料袋只含碳、氢两种元素,燃烧产物为二氧化碳和水。图中碱石灰可以吸收空气中的二氧化碳与水蒸气)
(1)按上面连接好装置,在装入药品之前,必须进行的操作是 。
(2)装置 A 中所发生的反应化学方程式为 。装置中 MnO2 粉末的作用是 。
(3)由于发生装置 A 制取的氧气中混有水蒸气,为不影响测定结果,装置B中盛放的试剂应该是_____________(写名称)。
(4)判断塑料袋试样中含有碳元素的依据是____________________________________。
(5)根据实验前后装置的质量变化测算出仪器D质量增重5.4g,仪器 E 质量增重 8.8g,则该塑料袋试样中碳元素与氢元素的质量比为______________。
(6)若实验过程中由于过氧化氢的量不足,塑料袋试样燃烧不充分,则该塑料试样中碳 元素与氢元素的质量比的测算结果 (填“一定偏大”、“一定偏小”、“基本一致”之一)。
老师在装有酸的储物柜中发现一瓶没有标签的溶液,让同学们鉴定该溶液是否为盐酸溶液。
| 实验步骤 |
实验现象 |
实验结论 |
| 1.取少量待测液体与试管中,滴加几滴石蕊溶液 |
溶液呈酸性 |
|
| 2.取少量待测液与试管中,滴加 溶液 |
产生了白色沉淀 |
该待测溶液为盐酸 |
| 3.往上述2中的沉淀滴加 溶液 |
写出上述操作2中所发生的化学方程式:。
小王和小张两位同学对实验探究有一定的心得,以下是他们探究盐酸和氢氧化钠溶液的实录,请你参与探究并完成相关的问题:小王根据下图的操作进行实验: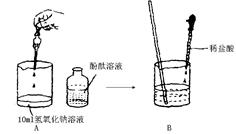
(1)A的现象是;
(2)B中随着稀盐酸的滴加左面图象能正确表示这个变化过程的是(填字母序号);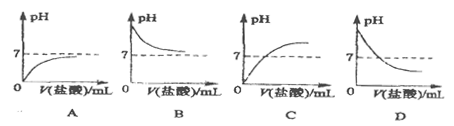
(3)小王认为,当B中溶液颜色刚好变成无色时,说明盐酸与氢氧化钠溶液恰好完全反应,此时溶液呈中性。
(4)小张实验:先向氢氧化钠溶液中滴加一定量的稀盐酸,再滴入酚酞试液,酚酞试液不变色,小张认为盐酸和氢氧化钠刚好完全反应。小干认为小张的实验设计思路不合理,理由是。
实验室提供了以下装置,现邀请你与某兴趣小组的同学一起来参加实验探究活动。
(1)指出编号仪器的名称:a,b。
(2)若用氯酸钾和二氧化锰来制取一瓶氧气,则应选用的装置是(填字母),
有关化学方程式,上述装置选择的依据是(填字母)。
| A.属于固固型加热的反应 | B.属于固液型不加热的反应 |
| C.制取的气体密度比空气大 | D.制取的气体难溶于水 |
(3)实验室用双氧水制取氧气的反应方程式为,该反应属于基本反应类型中的反应,该反应可选择的发生装置为;
(4)李同学设计了下(图1)装置制取和收集CO2,A装置中反应的化学方程式是。双氧水与MnO2粉末混合制氧气不能使用该装置的主要原因是。
(5)若要得到干燥的CO2,(图1)还需要一个干燥装置,干燥剂为浓硫酸[如(图2)所示]。请你用箭头在(图2)中标明气体进出方向。
在实验室配制石灰水时,小明同学将两药匙熟石灰样品放入小烧杯中,向其中加入一定量的蒸馏水,充分搅拌后发现烧杯底部仍有不溶性的固体,于是他认为熟石灰样品已经变质。小艳同学不同意他的判断,你认为小艳同学的理由是 。针对该熟石灰样品的成分同学们展开了讨论,请你参与讨论并完成实验报告。
【提出问题】熟石灰样品的主要成分是什么?
【作出猜想】甲同学猜想是Ca(OH)2;
乙同学猜想是CaCO3;
你认为是 。
【实验与结论】请你通过实验验证你的猜想:
| 实验步骤 |
实验现象 |
实验结论 |
| (1)取少量的熟石灰样品于烧杯中,加适量的水充分溶解后过滤。 向滤液中加入适量的溶液; (2)向滤出固体中加入适量。 |
(1) ; (2)。 |
猜想正确 |
实验课上,张影同学向盛有澄清石灰水的烧杯中加入过量的碳酸钠溶液,生成白色沉淀,过滤后得到无色溶液,他说:“我制得了氢氧化钠溶液!”
(1)余承骏同学却说:“这种无色溶液中不一定含有氢氧化钠。”他做了如下实验:
| 实验步骤 |
实验现象 |
实验结论 |
| 用试管取无色溶液少许,滴入2滴无色酚酞试液 |
无色酚酞试液变红 |
无色溶液中含有氢氧化钠 |
宋楷认为余承骏的实验方案不严密,不能证实无色溶液中一定含有氢氧化钠,理由是:。
(2)宋楷设计了另一个实验:
| 实验步骤 |
实验现象 |
实验结论 |
| ①取少量样品于试管中,加入足量的CaCl2溶液 ②过滤,向滤液中滴加几滴硫酸铜溶液 |
③ ④有蓝色沉淀生成 |
无色溶液中确实含有氢氧化钠 |
(3)宋楷的实验可靠性高的原因是。