把6 molA气体和5 molB气体混合放入4L恒容密闭容器中。在一定条件下发生反应:3A(g)+B(g) 2C(g)+xD(g),经过5 min后达到化学平衡,此时生成2 molC。又知在此时D的平均速率为0.15 mol·L-1·min-1。
2C(g)+xD(g),经过5 min后达到化学平衡,此时生成2 molC。又知在此时D的平均速率为0.15 mol·L-1·min-1。
求:(1)平衡时A的物质的量浓度; (2) B的转化率;(3) x的值。(要求写出计算过程)
 化合物A相对分子质量为86,碳的质量分数为55.8%,氢为7.0%,其余为氧。A的相关反应如下图所示:
化合物A相对分子质量为86,碳的质量分数为55.8%,氢为7.0%,其余为氧。A的相关反应如下图所示:



 已知R-CH=CHOH(烯醇)不稳定,很快转化为R-CH2CHO。
已知R-CH=CHOH(烯醇)不稳定,很快转化为R-CH2CHO。
 根据以上信息回答下列问题:
根据以上信息回答下列问题:
 (1)A的分子式为;
(1)A的分子式为;
 (2)反应②的化学方程式是;
(2)反应②的化学方程式是;
 (3)A的结构简式是
(3)A的结构简式是
 ;(4)反应①的化学方程式是;
;(4)反应①的化学方程式是;
 (5)A的另一种同分异构体,其分子中所有碳原子在一条直线上,它的结构简式为。
(5)A的另一种同分异构体,其分子中所有碳原子在一条直线上,它的结构简式为。
.已知有机物分子中的烯键可发生臭氧分解反应,
例如:R-CH=CH-CH2OH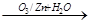 R-CH=O+O=CH-CH2OH。A的部分性质如图所示:
R-CH=O+O=CH-CH2OH。A的部分性质如图所示:
试根据上述信息结合所学知识写出A的结构简式。
氮化硼(
)是一种重要的功能陶瓷材料以天然硼砂为起始物,经过一系列反应可以得到
和
,如下图所示:
请回答下列问题:
(1)由
制备
、
的化学方程式依次是、;
(2)基态B原子的电子排布式为;B和N相比,电负性较大的是,
中B元素的化合价为;
(3)在
分子中,
的建角是,B原子的杂化轨道类型为,
和过量
作用可生成
,
的立体结构为;
(4)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为,层间作用力为;
(5)六方氢化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶苞边长为361.5
,立方氮化硼晶苞中含有各氮原子、各硼原子,立方氮化硼的密度是
(只要求列算式,不必计算出数值,阿伏伽德罗常数为
)。
1898年,曾有人发明了固氮的一种方法,该法以石灰石、焦炭、空气为原料。第一步反应是石灰石分解;第二步是使第一步反应产物和焦炭反应,在电炉中的高温下制得第三步反应起始物;第三步反应中另一反应物是空气,该反应也是在电炉中完成的,生成一种固体;第四步是使该固体和水蒸气反应制得氨气。又知该固体中有与N3-互为等电子体的离子。(1)试写出四步反应的化学方程式;
(2)试简评该固氮方法。
科学家们已经陆续从病死的家禽和候鸟体内分离到了H5N1亚型禽流感病毒(一种RNA病毒),现在若生产可以用于预防和治疗禽流感的抗体,请根据下面的单克隆抗体制备过程示意图回答有关问题:
(1)若A细胞是小鼠骨髓瘤细胞,则B细胞是取自感染病毒的动物或人体内的细胞,d过程的常用诱导方法是____________(写出两种方法)。细胞融合体现了细胞膜的特点是_____________________________________。
(2)假设仅考虑某两个细胞的融合,则可形成________种类型的C细胞,因此需要筛选出____________________________的D细胞用于培养。D细胞的名称是____________。
(3)在进行细胞培养时,一般要满足以下条件:________________________。(写出其中的两项)
(4)单克隆抗体技术在生物工程技术中占有重要的地位,请列举两项相关的应用:
____________________________________________________________________________。