关于原子或离子结构的下列说法不正确的是
| A.某原子K层上只有一个电子 |
| B.某原子M层上电子数为L层上电子数的4倍 |
| C.某离子M层上和L层上的电子数均为K层的4倍 |
| D.某离子核电荷数与最外层电子数相等 |
X、Y、Z、W、M五种元素的原子序数依次增大。已知X、Y、Z、W是短周期元素中的四种非金属元素,X元素的原子形成的离子就是一个质子;Y原子的最外层电子数是内层电子数的2倍;Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体;M是地壳中含量最高的金属元素。下列说法正确的是( )
| A.五种元素的原子半径从大到小的顺序是:M>W>Z>Y>X |
| B.X、Z两元素能形成原子个数比(X:Z)为3∶1和4∶2的化合物 |
| C.化合物YW2、ZW2都是酸性氧化物 |
| D.用M单质作阳极,石墨作阴极电解NaHCO3溶液,电解一段时间后,在阴极区会出现白色沉淀 |
还原沉淀法是处理含铬(Cr2O72-和CrO42-)废水常用方法,过程如下: ,已知废水中Cr的含量为26.0g·L-1,当溶液中离子浓度小于10-5mol/L时认为离子已经沉淀完全。常温下Ksp[Cr(OH)3]= 1×10-32。有关叙述中不正确的是()
,已知废水中Cr的含量为26.0g·L-1,当溶液中离子浓度小于10-5mol/L时认为离子已经沉淀完全。常温下Ksp[Cr(OH)3]= 1×10-32。有关叙述中不正确的是()
| A.上述三个转化中只有一个涉及氧化还原反应 |
| B.第二步离子方程式为:Cr2O72-+14H++6Fe2+=2Cr3++7H2O+6Fe3+ |
| C.处理含铬废水可使用强碱Ba(OH)2,也可以使用弱碱氨水 |
| D.当pH≥5时,废水中铬元素沉淀完全 |
下列图示与对应的叙述相符的是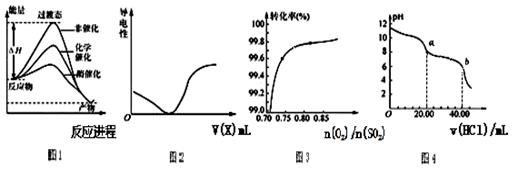
| A.由图1所示曲线可知,化学催化比酶催化的效果好 |
| B.在H2S溶液导电性实验中,由图2所示曲线可确定通入的气体X可能是SO2,不可能为Cl2 |
C.在其它条件不变时,2SO2(g)+ O2(g)  2SO3(g)转化关系(图3)中,纵坐标表示O2的转化率 2SO3(g)转化关系(图3)中,纵坐标表示O2的转化率 |
| D.图4是用0.l000 mol/L的盐酸滴定20.00 mL 0.l000mol/LNa2CO3溶液的曲线,从a→b点反应的离子方程式为:CO32--+2H+=CO2↑+H2O |
设NA为阿伏加德罗常数的数值,下列说法正确的是
| A.1.0mol/L的NaAlO2水溶液中含有的AlO2-的数目小于NA |
| B.标准状况下,33.6 L四氯化碳中含有氯原子的数目为6NA |
| C.1 mol FeI2与足量氯气反应时转移的电子数为2NA |
| D.在P4+CuSO4+H2O → Cu3P+H3PO4+H2SO4(未配平)的反应中,生成1 mol Cu3P时,参加反应的P4分子数目为0.55NA |
茶叶中铁元素的检测可经过以下A、B、C、D四个步骤完成,各步骤中选用的实验仪器不会全部都用上的是
A.将茶叶灼烧灰化,选用①、②和⑨
B.用浓硝酸溶解茶叶灰并加蒸馏水稀释,选用④和⑦
C.过滤得到滤液,选用④、⑤、⑦和⑨
D.检验滤液中的Fe3+,选用③和⑧