请用相关知识回答下列问题:
(1)用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体,实验过程测得的CO2气体体积随时间变化如右图所示。
①________段化学反应速率最快,_______段收集的二氧化碳气体最多。
②除加入蒸馏水外,当加入下列物质中的 (填序号)时,则能够减缓上述反应的速率。
A.醋酸钠溶液 B.碳酸钙粉末 C.稀硫酸 D.浓盐酸
(2)原电池是一种能量装置。
①下列在理论上可用来设计原电池的反应是 (填序号)。
A.NaOH +HCl==NaCl+H2O B.2FeCl3+Cu=2FeCl2+CuCl2
C.CuSO4 +2NaOH== Cu(OH)2+NaSO4 D.C2H6O +3O2==3H2O+2CO2
②实验室中用锌片与硫酸反应制取氢气时,向反应溶液中滴加几滴CuSO4溶液,可以发现产生氢气速率明显加快,其原因是 。
化学反应原理在科研和生产中有广泛应用。
(1)利用“化学蒸气转移法”提纯金属钨的反应原理为W(s)+I2(g) WI2(g)。该反应在石英真空管中进行,如下图所示:
WI2(g)。该反应在石英真空管中进行,如下图所示: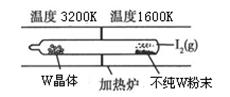
①该反应的平衡常数表达式K=_______,若K=1/2,向某恒容密闭容器中加入1mol I2(g)和足量W(s),反应达到平衡时I2(g)的转化率为__________。
②该反应的△H____0(填“>”或“<”),上述反应体系中可循环使用的物质____。
③能够说明上述反应已经达到平衡状态的有_________(填序号)。
a.I2与WI2的浓度相等
b.W的质量不再变化
c.容器内混合气体的密度保持不变
d.单位时间内,金属钨消耗的物质的量与碘化钨生成的物质的量相等
(2)利用“隔膜电解法”处理高浓度乙醛废水的工艺具有流程简单、能耗较低等优点,其原理是使乙醛分别在阴、阳极发生反应生成乙醇和乙酸,总反应式为2CH3CHO+H2O CH3CH2OH+CH3COOH,实验室中,以一定浓度的乙醛和Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示。
CH3CH2OH+CH3COOH,实验室中,以一定浓度的乙醛和Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示。
①若以甲烷碱性燃料电池为直流电源,则燃料电池中b极应通入__________(填化学式)。
②电解池阳极区的电极反应式为_________________。
③在实际工艺处理中,阴极区乙醛的去除率可达60%。若在两极区分别注入1 m3乙醛含量为3000 mg·L-1的废水,可得到乙醇________kg(计算结果保留小数点后一位)。
二氧化碳是引起“温室效应”的主要物质,节能减排,高效利用能源,能够减少二氧化碳的排放。
(1)有一种用CO2生产甲醇燃料的方法:
已知:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-a kJ·mol-1;
CH3OH(g)+H2O(g)△H=-a kJ·mol-1;
CH3OH(g)=CH3OH(l)△H=-b kJ·mol-1;
2H2(g)+O2(g)=2H2O(g) △H=-c kJ·mol-1;
H2O(g)=H2O(l) △H=-d kJ·mol-1,
则表示CH3OH(l)燃烧热的热化学方程式为:_____________________________。
(2)在一定温度下的2L固定容积的密闭容器中,通入2 molCO2和3mol H2,发生的反应为:
CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-a kJ/mol(a>0), 测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g)△H=-a kJ/mol(a>0), 测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。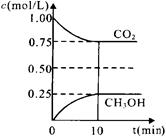
①能说明该反应已达平衡状态的是________。(选填编号)
A.CO2的体积分数在混合气体中保持不变
B.混合气体的平均相对分子质量不随时间的变化而变化
C.单位时间内每消耗1.2mol H2,同时生成0.4molH2O
D.该体系中H2O与CH3OH的物质的量浓度之比为1:1,且
保持不变
②计算该温度下此反应的平衡常数K=_______。(保留两位有效数字)。若改变条件(填选项),可使K=1。
A.增大压强
B.增大反应物浓度
C.降低温度
D.升高温度
E.加入催化剂
(3)某甲醇燃料电池原理如图1所示。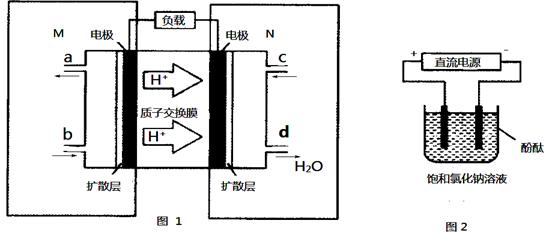
①M区发生反应的电极反应式为_______________________________。
②用上述电池做电源,用图2装置电解饱和食盐水(电极均为惰性电极),则该电解的总反应离子方程式为:。假设溶液体积为300mL,当溶液的pH值变为13时(在常温下测定),理论上消耗甲醇的质量为______________(忽略溶液体积变化)。
非金属元素H、C、O、S、Cl能形成的化合物种类很多,单质及化合物的用途很广泛。
(1)O2-的离子结构示意图为,CS2的晶体类型为晶体;
(2)O、Cl两元素形成的单质和化合物常用来杀菌消毒,试举例________(写化学式,任写两种);
(3)CH3OH在常温下为液态,沸点高于乙烷的主要原因是;
(4)Cl2是一种大气污染物,液氯储存区贴有的说明卡如下(部分):
| 危险性 |
 |
| 储运要求 |
远离金属粉末、氨、烃类、醇类物质;设置氯气检测仪 |
| 泄漏处理 |
NaOH、NaHSO3溶液吸收 |
| 包装 |
钢瓶 |
①用离子方程式表示“泄漏处理”中NaHSO3溶液的作用。
②若液氯泄漏后遇到苯,在钢瓶表面氯与苯的反应明显加快,原因是。
③将Cl2通入适量KOH溶液中,产物中可能有KCl、KClO、KClO3。当溶液中c(Cl-):c(ClO-)=11:1时,则c(ClO-):c(ClO3-)比值等于。
(5)镁是一种较活泼的金属,Mg与Ca类似,也能与C形成某种易水解的离子化合物。已知该化合物0.1mol与水完全反应后,产生0.1mol的某种气体。该气体被溴水全部吸收后,溴水增重2.6g。请写出该水解反应方程式。
X、Y、Z、J、Q五种短周期主族元素,原子序数依次增大,元素Z在地壳中含量最高,J元素的焰色反应呈黄色,Q的最外层电子数与其电子总数比为3:8,X能与J形成离子化合物,且J+的半径大于X—的半径,Y的氧化物是形成酸雨的主要物质之一。请回答:
(1)Q元素在周期表中的位置_______________________;
(2)这五种元素原子半径从大到小的顺序为_________________________________(填元素符号)。
(3)元素的非金属性Z____Q(填“>”或“<”),下列各项中,不能说明这一结论的事实有____(填序号)
A.Q的氢化物的水溶液放置在空气中会变浑浊
B.Z与Q之间形成的化合物中元素的化合价
C.Z和Q的单质的状态
D.Z和Q在周期表中的位置
(4)Q的氢化物与Z的氢化物反应的化学方程式为____________________________________。
(5)X与Y可形成分子A,也可形成阳离子B,A、B在水溶液中酸、碱性恰好相反,写出A的电子式_______________;B的水溶液不呈中性的原因____________________________(用离子方程式表示)。
(6)液态A类似X2Z,也能微弱电离且产生电子数相同的两种离子,则液态A的电离方程式为_______;
(7)若使A按下列途径完全转化为F:
①F的化学式为_________;
②参加反应的A与整个过程中消耗D的物质的量之比为_________。
一定温度下,在恒容密闭容器中充入2molNO2与1molO2发生反应如下:
4NO2(g)+O2(g) 2N2O5(g)
2N2O5(g)
(1)已知平衡常数K350℃<K300℃,则该反应是_________反应(填“吸热”或“放热”);常温下,该反应能逆向自发进行,原因是_______________________________________。
(2)下列有关该反应的说法正确的是___________。
A.扩大容器体积,平衡向逆反应方向移动,混合气体颜色变深
B.恒温恒容下,再充入2molNO2和1molO2,再次达到平衡时NO2转化率增大
C.恒温恒容下,当容器内的密度不再改变,则反应达到平衡状态
D.若该反应的平衡常数增大,则一定是降低了温度
(3)氮的化合物种类较多,如NH3、NO、NO2、HNO3、硝酸盐等。
①亚硝酸是一种弱酸,能证明亚硝酸是弱电解质的是__________。
A.常温下,亚硝酸钠溶液的pH>7
B.亚硝酸能和NaOH发生中和反应
C.用亚硝 酸 溶液做导电性实验,灯泡很暗
D.常温下,将pH=3的亚硝酸溶液稀释10倍 ,pH<4
②根据酸碱质子理论,凡是能给出质子的分子或离子都是酸,凡是能结合质子的分子或离子都是碱。按照这个理论,下列微粒属于两性物质的是___________。
a.H2O
b.NO2-
c.H2NCH2COOH
d.H2PO4-
e.H2S
③氮同主族磷元素形成的Na2HPO4溶液显碱性,若向溶液中加入足量的CaCl2溶液,溶液则显酸性,其原因是___________________________________________(用离子方程式表示)。
(4)X、Y、Z、W分别是HNO3、NH4NO3、NaOH、NaNO2四种强电解质中的一种。下表是常温下浓度均为0.01 mol·L-1的X、Y、Z、W溶液的pH。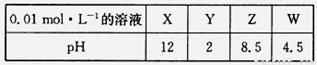
将X、Y、Z各1mol·L-1同时溶于水中制得混合溶液,则混合溶液中各离子的浓度由大到小的顺序为 ________________________________________________。
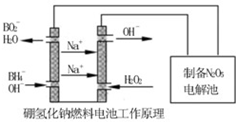
(5)N2O5是一种新型绿色硝化剂,其制备可以用硼氢化钠燃料电池作电源,采用电解法制备得到N2O5,工作原理如图。则硼氢化钠燃料电池的负极反应式为。