二氧化碳是引起“温室效应”的主要物质,节能减排,高效利用能源,能够减少二氧化碳的排放。
(1)有一种用CO2生产甲醇燃料的方法:
已知:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-a kJ·mol-1;
CH3OH(g)+H2O(g) △H=-a kJ·mol-1;
CH3OH(g)=CH3OH(l) △H=-b kJ·mol-1;
2H2(g)+O2(g)=2H2O(g) △H=-c kJ·mol-1;
H2O(g)=H2O(l) △H=-d kJ·mol-1,
则表示CH3OH(l)燃烧热的热化学方程式为:_____________________________。
(2)在一定温度下的2L固定容积的密闭容器中,通入2 molCO2和3mol H2,发生的反应为:
CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-a kJ/mol(a>0), 测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g)△H=-a kJ/mol(a>0), 测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。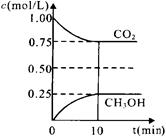
①能说明该反应已达平衡状态的是________。(选填编号)
A.CO2的体积分数在混合气体中保持不变
B.混合气体的平均相对分子质量不随时间的变化而变化
C.单位时间内每消耗1.2mol H2,同时生成0.4molH2O
D.该体系中H2O与CH3OH的物质的量浓度之比为1:1,且
保持不变
②计算该温度下此反应的平衡常数K=_______。(保留两位有效数字)。若改变条件 (填选项),可使K=1。
A.增大压强
B.增大反应物浓度
C.降低温度
D.升高温度
E.加入催化剂
(3)某甲醇燃料电池原理如图1所示。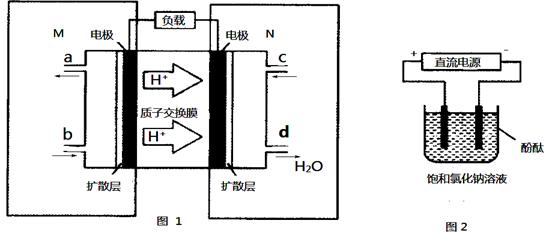
①M区发生反应的电极反应式为_______________________________。
②用上述电池做电源,用图2装置电解饱和食盐水(电极均为惰性电极),则该电解的总反应离子方程式为: 。假设溶液体积为300mL,当溶液的pH值变为13时(在常温下测定),理论上消耗甲醇的质量为______________(忽略溶液体积变化)。
CO和H2的混合气体俗称合成气,是一种重要的工业原料气,工业上利用天然气(主要成分为CH4)与水进行高温重整制备合成气。
(1)已知:CH4、H2和CO的燃烧热(△H)分别为-890.3kJ/mol、-285.8kJ/mol和-283.0kJ/mol,且1mol液态水汽化时的能量变化为44.0kJ。用1 m3(标准状况)的甲烷与水蒸气在高温下反应制取合成气所需的热量为(保留整数)。
(2)在一定温度下,向体积为2L的密闭容器中充入0.40mol CH4和0.60mol H2O(g),测得CH4(g)和H2(g)的物质的量浓度随时间变化如下表所示:
| 物质浓度 时间/min |
0 |
1 |
2 |
3 |
4 |
| CH4 |
0.2mol·L-1 |
0.13 mol·L-1 |
0.1 mol·L-1 |
0.1 mol·L-1 |
0.09 mol·L-1 |
| H2 |
0 mol·L-1 |
0.2 mol·L-1 |
0.3 mol·L-1 |
0.3 mol·L-1 |
0.33 mol·L-1 |
①计算该反应第一次达平衡时的平衡常数K。
②3min时改变的反应条件是(只填一种条件的改变即可)。
(3)已知温度、压强、投料比X[n(CH4)/n(H2O)]对该反应的影响如图所示。
①图1中的两条曲线所示投料比的关系X1 X2(填“=”、“>”或“<”下同)。
②图2中两条曲线所示的压强比的关系:P1 P2。
(4)以天然气(设杂质不参与反应)、KOH溶液为原料可设计成燃料电池:
①放电时,负极的电极反应式为。
②设装置中盛有100.0mL 3.0mol/L KOH溶液,放电时参与反应的氧气在标准状况下的体积为8.96L,放电过程中没有气体逸出,则放电完毕后,所得溶液中各离子浓度由大到小的关系为。
铵盐是一种重要的水体污染物。某课题组利用电解法,在含Cl-的水样中,探究将NH4+转化为N2而脱氮的影响因素和反应机理。
(1)电解法脱氮的原理可能如下:
①直接电氧化
在碱性条件下,发生2NH3 + 6OH- - 6e- = N2 + 6H2O反应的电极为(填“阴”、“阳”)极;
②-OH(自由羟基)电氧化
在电流作用下,利用产生的强氧化性中间产物OH脱氮,-OH中O元素的化合价;
③间接电氧化
利用电解产生的Cl2,与H2O作用生成HClO进行脱氮。请写出HClO在酸性条件下氧化NH4+的离子方程式。
(2)探究适宜的实验条件
下图为不同电流强度下脱氮的效果,综合考虑能耗因素,电流强度应选择A。
(3)该课题组进一步探究脱氮过程中的强氧化性的活性中间产物,提出了如下假设,请你完成假设三:
假设一:只有·OH;
假设二:只有HClO;
假设三:。
(4)请你设计实验探究脱氮过程中是否有·OH产生,完成下表内容。
| 实验方案 |
预期实验结果和结论 |
| 配制一定pH、NH4+和Cl-浓度的溶液,用最佳电流强度,电解样品90min后,采用电子自旋共振法检测样品中·OH |
(5)研究得知,脱氮过程主要以原理③为主,弱酸性溶液中比强酸溶液中更利于使NH4+转化为N2而脱氮,请从化学平衡移动的角度解释其原因。
下图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系。请回答下列问题: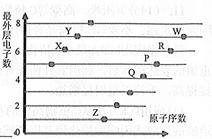
(1)Y在元素周期表中位于第____周期、第 族;P的基态原子核外电子排布式为________。
(2)Y、P、R第一电离能大小的顺序为(用化学符号表示,下同),X、R、W的气态氢化物水溶液酸性大小顺序为。
(3)X、Z的单质按物质的量比1:2反应生成的化合物中化学键类型有;计算2mol该化合物与标准状况下33. 6LCO2和l0mol水蒸气混合物充分反应后转移电子的物质的量是。
(4)Q单质与Z的最高价氧化物对应水化物的浓溶液反应,化学方程式为。
(5)已知:反应I CaSO4( s)+CO(g) CaO(s)+SO2(g)+CO2(g) △H=+218.4kJ/mol
CaO(s)+SO2(g)+CO2(g) △H=+218.4kJ/mol
反应Ⅱ CaSO4(s)+4CO(g) CaS(s)+4CO2(g) △H=-175.6kJ/mol
CaS(s)+4CO2(g) △H=-175.6kJ/mol
假设某温度下,反应I的速率(v1)大于反应II的速率(v2),则下列反应过程能量变化示意图正确的是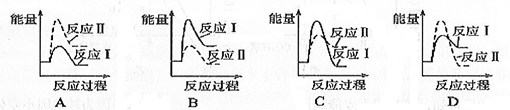
铁是目前人类使用量最大的金属,它能形成多种化合物。
(1)取5.6 g的生铁与足量的稀硫酸混合反应,无论怎样进行实验,最终收集了的气体体积均小于2.24 L(标准状况),最主要的原因是__________,所得溶液在长时间放置过程中会慢慢出现浅黄色,试用离子方程式解释这一变化的原因______________。
(2)ZnFe2Ox是一种新型纳米材料,可将工业废气中的某些元素转化为游离态,制取纳米ZnFe2Ox 和用于除去废气的转化关系如图 。
。
若上述转化反应巾消耗的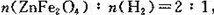 ,x的值为____________________。请写出 ZnFe2Ox与NO2反应的化学方程式________________________(x用前一问求出的具体值)。
,x的值为____________________。请写出 ZnFe2Ox与NO2反应的化学方程式________________________(x用前一问求出的具体值)。
(3)LiFePO4(难溶干水)材料被视为最有前途的锂离子电池材料之一。
①以FePO4(难溶于水)、Li2CO3、单质碳为原料在高温下制备LiFePO4,,该反应还生成一种可燃性气体,则反应方程式为____________________________.
②磷酸铁锂动力电池有几种类型,其中一种(中间是锂离子聚合物的隔膜,它把正极与负桩隔开)工作原理为 。则放电时正极上的电极反应式为____________________.
。则放电时正极上的电极反应式为____________________.
(4)已知25℃时, ,此温度下若在实验室中配制5 mol/L 100 mL FeCl3溶液,为使配制过程中不出现浑浊现象,则至少需要加人________ml,2 mol/L。的盐酸(忽略加入盐酸体积)。
,此温度下若在实验室中配制5 mol/L 100 mL FeCl3溶液,为使配制过程中不出现浑浊现象,则至少需要加人________ml,2 mol/L。的盐酸(忽略加入盐酸体积)。
制备多晶硅(硅单质的一种)的副产物以SiCl4为主,其对环境污染很大,遇水强烈水解,放出大量热量。研究人员利用SiCl4水解生成的盐酸和钡矿粉(主要成份为BaCO3,含有钙、铁、镁等离子)制备BaCl2·2H2O,流程为:
已知常温下Fe3+、Mg2+完全沉淀的pH分别是3.4和12.4;
(1)①SiCl4水解控制在40℃以下的原因是。
②已知:SiCl4(s)+H2(g)=SiHCl3(s)+HCl(g)ΔH1=47 kJ/mol
SiHCl3(s)+H2(g)=Si(s)+3HCl(g)ΔH2=189 kJ/mol
则SiCl4被H2还原制备硅的热化学方程式。
(2)加钡矿粉时生成BaCl2的离子反应方程式。
(3)过滤②的滤渣A的成分化学式为;接着往滤液中加20% NaOH调节pH=12.5,控制温度70℃时,滤渣B的主要成分的化学式,控制温度70℃的目的。
(4)滤液③经、过滤等操作,再经真空干燥后得到BaCl2·2H2O。