铵盐是一种重要的水体污染物。某课题组利用电解法,在含Cl-的水样中,探究将NH4+转化为N2而脱氮的影响因素和反应机理。
(1)电解法脱氮的原理可能如下:
①直接电氧化
在碱性条件下,发生2NH3 + 6OH- - 6e- = N2 + 6H2O反应的电极为 (填“阴”、“阳”)极;
②-OH(自由羟基)电氧化
在电流作用下,利用产生的强氧化性中间产物OH脱氮,-OH中O元素的化合价 ;
③间接电氧化
利用电解产生的Cl2,与H2O作用生成HClO进行脱氮。请写出HClO在酸性条件下氧化NH4+的离子方程式 。
(2)探究适宜的实验条件
下图为不同电流强度下脱氮的效果,综合考虑能耗因素,电流强度应选择 A。
(3)该课题组进一步探究脱氮过程中的强氧化性的活性中间产物,提出了如下假设,请你完成假设三:
假设一:只有·OH;
假设二:只有HClO;
假设三: 。
(4)请你设计实验探究脱氮过程中是否有·OH产生,完成下表内容。
| 实验方案 |
预期实验结果和结论 |
| 配制一定pH、NH4+和Cl-浓度的溶液,用最佳电流强度,电解样品90min后,采用电子自旋共振法检测样品中·OH |
|
(5)研究得知,脱氮过程主要以原理③为主,弱酸性溶液中比强酸溶液中更利于使NH4+转化为N2而脱氮,请从化学平衡移动的角度解释其原因 。
下图是某元素及其重要化合物之间的相互转化关系图(生成物中不含该元素的物质均已略去)。其中A是单质,D在常温下呈气态,F可用作氮肥。
据此,请回答下列问题:
(1)写出物质的化学式:A ,D ,F 。
(2)写出下列变化的化学方程式:
B→C 。
E→C 。
 化合物A相对分子质量为86,碳的质量分数为55.8%,氢为7.0%,其余为氧。A的相关反应如下图所示:
化合物A相对分子质量为86,碳的质量分数为55.8%,氢为7.0%,其余为氧。A的相关反应如下图所示:



 已知R-CH=CHOH(烯醇)不稳定,很快转化为R-CH2CHO。
已知R-CH=CHOH(烯醇)不稳定,很快转化为R-CH2CHO。
 根据以上信息回答下列问题:
根据以上信息回答下列问题:
 (1)A的分子式为;
(1)A的分子式为;
 (2)反应②的化学方程式是;
(2)反应②的化学方程式是;
 (3)A的结构简式是
(3)A的结构简式是
 ;(4)反应①的化学方程式是;
;(4)反应①的化学方程式是;
 (5)A的另一种同分异构体,其分子中所有碳原子在一条直线上,它的结构简式为。
(5)A的另一种同分异构体,其分子中所有碳原子在一条直线上,它的结构简式为。
.已知有机物分子中的烯键可发生臭氧分解反应,
例如:R-CH=CH-CH2OH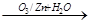 R-CH=O+O=CH-CH2OH。A的部分性质如图所示:
R-CH=O+O=CH-CH2OH。A的部分性质如图所示:
试根据上述信息结合所学知识写出A的结构简式。
氮化硼(
)是一种重要的功能陶瓷材料以天然硼砂为起始物,经过一系列反应可以得到
和
,如下图所示:
请回答下列问题:
(1)由
制备
、
的化学方程式依次是、;
(2)基态B原子的电子排布式为;B和N相比,电负性较大的是,
中B元素的化合价为;
(3)在
分子中,
的建角是,B原子的杂化轨道类型为,
和过量
作用可生成
,
的立体结构为;
(4)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为,层间作用力为;
(5)六方氢化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶苞边长为361.5
,立方氮化硼晶苞中含有各氮原子、各硼原子,立方氮化硼的密度是
(只要求列算式,不必计算出数值,阿伏伽德罗常数为
)。
1898年,曾有人发明了固氮的一种方法,该法以石灰石、焦炭、空气为原料。第一步反应是石灰石分解;第二步是使第一步反应产物和焦炭反应,在电炉中的高温下制得第三步反应起始物;第三步反应中另一反应物是空气,该反应也是在电炉中完成的,生成一种固体;第四步是使该固体和水蒸气反应制得氨气。又知该固体中有与N3-互为等电子体的离子。(1)试写出四步反应的化学方程式;
(2)试简评该固氮方法。