制备多晶硅(硅单质的一种)的副产物以SiCl4为主,其对环境污染很大,遇水强烈水解,放出大量热量。研究人员利用SiCl4水解生成的盐酸和钡矿粉(主要成份为BaCO3,含有钙、铁、镁等离子)制备BaCl2·2H2O,流程为:
已知常温下Fe3+、Mg2+完全沉淀的pH分别是3.4和12.4;
(1)①SiCl4水解控制在40℃以下的原因是 。
②已知:SiCl4(s)+H2(g)=SiHCl3(s)+HCl(g) ΔH1=47 kJ/mol
SiHCl3(s)+H2(g)=Si(s)+3HCl(g) ΔH2=189 kJ/mol
则SiCl4被H2还原制备硅的热化学方程式 。
(2)加钡矿粉时生成BaCl2的离子反应方程式 。
(3)过滤②的滤渣A的成分化学式为 ;接着往滤液中加20% NaOH调节pH=12.5,控制温度70℃时,滤渣B的主要成分的化学式 ,控制温度70℃的目的 。
(4)滤液③经 、过滤等操作,再经真空干燥后得到BaCl2·2H2O。
野外焊接钢轨的铝热反应
某同学用容量瓶配制溶液,加水时不慎超过了刻度线,他把水倒出了一些,重新加水至刻度线,这种做法是否正确,如果不正确,会造成什么后果?该采取什么措置补救?
如果不慎将油汤洒到了衣服上,可以用什么方法除去?(用两种方法)
(1)有人研究证明:使用氯气作自来水消毒剂,氯气会与水中有机物反应,生成如CHCl 3等物质,这些物质可能是潜在的致癌致畸物质。目前人们已研发多种饮用水的新型消毒剂。下列物质不能作自来水消毒剂的是()(填序号)。
3等物质,这些物质可能是潜在的致癌致畸物质。目前人们已研发多种饮用水的新型消毒剂。下列物质不能作自来水消毒剂的是()(填序号)。
| A.明矾 | B.二氧化氯 | C.臭氧 | D.高铁酸钠( Na2FeO4) |
(2)高铁(VI)酸盐是新一代水处理剂。其制备方法有:次氯酸盐氧化法(湿法)和高温过氧化物法(干法)等。湿法是在碱性溶液中用次氯酸盐氧化铁(III)盐,写出该法的离子方程式:。
(3)用高铁(VI)酸盐设计的高铁(VI)电池是一种新型可充电电池,电解质溶液为KOH溶液,放电时的总反应:3Zn+2K2FeO4+8H2O→3Zn(OH)2+2Fe(OH)3+4KOH
①写出正极发生的电极反应式:。
②用高铁(VI)电池作电源,以Fe作阳极,以Cu作阴极,对足量KOH溶液进行电解,当有0.1molK2FeO4反应时,在电解池中生成H2L(标准状况).
③下表列出了某厂排放的含锌废水中的含量及国家环保标准值的有关数据:
| 含锌废水水质 |
经处理后的水国家环保标准值 |
|
| Zn2+浓度/(mg·L) |
≤800 |
≤3.9 |
| pH |
1~5 |
6~9 |
经处理后的废水pH=8,此时废水中Zn2+的浓度为mg/L(常温下,Ksp[Zn(OH)2]=1.2×10-17),(填“符合”或“不符合”)国家环保标准。
向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色。如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色。
完成下列填空:
1) 写出并配平CCl4层由紫色变成无色的化学反应方程式(如果系数是1,不用填写):
写出产物即可不需要配平
2)整个过程中的还原剂是。
3)把KI换成KBr,则CCl4层变为色:继续滴加氯水,CCl4层的颜色没有变化。由此推测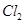 、
、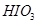 、
、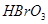 氧化性由强到弱的顺序是。
氧化性由强到弱的顺序是。