向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色。如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色。
完成下列填空:
1) 写出并配平CCl4层由紫色变成无色的化学反应方程式(如果系数是1,不用填写):
写出产物即可不需要配平
2)整个过程中的还原剂是 。
3)把KI换成KBr,则CCl4层变为 色:继续滴加氯水,CCl4层的颜色没有变化。由此推测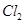 、
、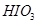 、
、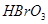 氧化性由强到弱的顺序是 。
氧化性由强到弱的顺序是 。
铁、铝、铜等金属及其化合物在日常生活中应用广泛,请根据下列实验回答问题:
(1)单质铁属于晶体,将FeCl3溶液加热蒸干、灼烧所得的物质是(填化学式).
(2)请写出铝与氢氧化钠溶液反应的化学方程式____
(3)金属Cu单独与氨水或单独与双氧水都不反应,但可与二者的混合溶液反应生成深蓝色溶液,该深蓝色的浓溶液中加入乙醇所产生的现象是,画出呈深蓝色的离子的结构式____写出Cu与氨水、双氧水反应的离子方程式:____
(4)在硫酸亚铁溶液中加入过量的碳酸氢铵,有FeCO3沉淀生成,写出其化学方程式____
( 14分)某化学小组进行Na2O2与水反应的实验,如下图所示,该小组对试管c中红色褪去的原因进行探究。
(1)Na2O2中含有的化学键类型:;请写出a中反应的化学方程式。
查阅资料:
①当NaOH溶液pH≥13时,可以使酚酞由红色褪为无色;
②Na2O2与水反应分两步进行:Na2O2 + H2O =" NaOH" + H2O2 2H2O2 = 2H2O + O2↑
(2)请设计实验验证Na2O2与水反应后的溶液中有H2O2残留:取少量b溶液于试管中,,证明溶液中有H2O2残留。
(3)结合资料,该小组同学针c中溶液红色褪去的原因提出以下假设:
①;
② 溶液中H2O2破坏酚酞的结构;
③ NaOH和H2O2共同作用结果。
(4)该小组同学测出c中溶液的pH为14,认为还不能排除假设②、③,于是又进行了如下实验,请完成下表空白处:
| 实验 |
操作 |
现象 |
结论 |
| 1 |
向少量H2O2中滴加2滴酚酞,放置一段时间,再加入NaOH溶液至pH=12 |
加入NaOH后,无色溶液先变红,后褪色 |
① |
| 2 |
向少量 NaOH溶液(pH=14)中滴加2滴酚酞;再加适量稀盐酸至溶液 pH=12 |
溶液先变红,后褪色;加盐酸后,又出现红色,且不褪色 |
 |
| 3 |
向Na2O2与水反应后的溶液(pH=14)中滴加2滴酚酞;再加适量稀盐酸至溶液 pH=12 …… |
② …… |
溶液pH大于13时,NaOH使变红的溶液褪色;pH在8~13时, NaOH和H2O2共同作用使溶液褪色 |
(5)某同学按取(4)中述实验2褪色后的溶液,加水稀释至pH=12,没有观察到溶液变红。该同学推测实验2加盐酸后溶液变红还可能与温度有关,请写出理由:。
最近全国各地持续出现雾霾天气,其首要污染物是可吸入颗粒物PM2.5和氮、硫的氧化物(PM2.5直径接近2.5×10-6m,1纳米=10-9m),主要来源为工业废气、机动车尾气等。因此对PM2.5、SO2、NOx进行研究、处理意义重大。
(1) 下列关于PM2.5说法正确的是
a.PM2.5在空气中形成了胶体;
b.PM2.5表面积大,能吸附大量有毒、有害物质;
c.少开私家车,尽量选择公交、地铁出行,某种程度可以减少PM2.5污染
(2) 取PM2.5样本用蒸馏水处理制得试样,若测得该试样所含水溶性无机离子及其平均
浓度如下表
| 离子 |
K+ |
Na+ |
NH4+ |
SO42- |
NO3- |
Cl- |
| 浓度/ mol/L |
4×10-6 |
6×10-6 |
2×10-5 |
4×10-5 |
3×10-5 |
2×10-5 |
根据表中的数据判断该试样的酸碱性为,其pH=。
(3)对汽车尾气中的NOx进行研究
①NOx能形成酸雨,写出NO2转化为HNO3的化学方程式。
②汽车尾气系统中装有催化转化器,可将NOx还原成N2排出,已知下列热化学方程式:
ⅰ N2(g) +O2(g)  2NO(g) △H=+180.5kJ·mol-1
2NO(g) △H=+180.5kJ·mol-1
ⅱ 2C(s)+ O2(g) 2CO(g)△H ="-" 221.0 kJ·mol-1
2CO(g)△H ="-" 221.0 kJ·mol-1
ⅲC(s)+ O2(g) CO2( g) △H ="-" 393.5 kJ·mol-1
CO2( g) △H ="-" 393.5 kJ·mol-1
温度升高,反应ⅲ化学平衡常数。(填“增大”或“减小”或“不变”)
写出NO(g)和CO(g) 反应生成N2(g) CO2(g)的热化学方程式。
(4)将工厂废气中产生的SO2通过下列流程,可以转化为有应用价值的硫酸钙等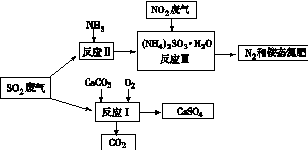
①写出反应Ⅰ的化学方程式:。
②生产中,向反应Ⅱ的溶液中加入强还原性的对苯二酚等物质,目的是。
③检验经过反应Ⅲ得到的氨态氮肥中SO42-所用试剂是。
(17分)贝诺酯又名扑炎痛,主要用于类风湿性关节炎、感冒、头痛等治疗。贝诺酯可由化合物Ⅰ--阿司匹林和化合物Ⅱ---扑热息痛合成。其合成路线如下: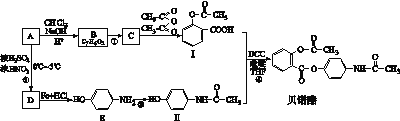
已知:
(1)化合物A遇FeCl3发生显色反应,相对分子质量小于100, A的分子式为。
(2)红外光谱显示B中含有C-H键、O-H键、C-O键和C=O键的红外吸收峰,且B中苯环上有两个取代基,B的结构简式为。
(3)E的官能团名称是,反应①--④中不属于取代反应的是。
(4)1 mol化合物Ⅰ与足量NaOH溶液共热,最多消耗NaOHmol。
(5)写出C→化合物Ⅰ的化学方程式。
(6)满足以下条件的化合物Ⅱ的同分异构体有种。
① 属于芳香族化合物
②含有-NH2、-COOH、不含-CH3
写出其中含有一个取代基的同分异构在一定条件下生成高聚物化学方程式。
(14分)2013年初,雾霾天气多次肆虐天津、北京等地区。其中,燃煤和汽车尾气是
造成空气污染的原因之一。
(l)汽车尾气净化的主要原理为:2NO(g) + 2CO(g) 2CO2(g)+ N2(g)△H <0
2CO2(g)+ N2(g)△H <0
①该反应平衡常数表达式____________________________
②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是________________(填代号)。
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
已知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol①
2NO2(g) N2O4(g)△H=-56.9 kJ/mol②
N2O4(g)△H=-56.9 kJ/mol②
H2O(g)=H2O(l)△H=-44.0 kJ/mol③
写出CH4催化还原N2O4(g)生成N2和H2O(1)的热化学方程式:_____________________。
(3)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解100mLlmol/L食盐水,电解一段时间后,收集到标准状况下的氢气2.24L(设电解后溶液体积不变).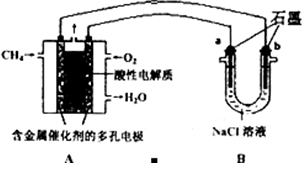
①甲烷燃料电池的负极反应式:______________________________________.
②电解后溶液的pH=____(忽略氯气与氢氧化钠溶液反应)
③阳极产生气体的体积在标准状况下是________L