化学兴趣小组用下图所示装置进行探究实验。以验证产物中有乙烯生成且乙烯具有不饱和性。
当温度迅速上后,可观察到试管中的溴水褪色,烧瓶中浓H2SO4与乙醇的混合液体变为棕黑色。(已知:二溴乙烷密度2.18 g·cm-3,不易溶于水,易溶于醇、醚、丙酮等有机溶剂)。
请回答下列问题:
(1)该实验中生成乙烯的化学方程式:_______________________________________。
(2)甲同学认为:该混合液体反应复杂,溴水褪色的现象不能证明反应中有乙烯生成及乙烯具有不饱和性。下列理由中正确的是 __________(填选项)。
A.乙烯与溴水易发生取代反应 B.使溴水褪色的反应,未必是加成反应
C.使溴水褪色的物质,未必是乙烯 D.浓硫酸氧化乙醇生成乙酸,也会使溴水褪色
(3)乙同学对上述实验装置进行了改进,在Ⅰ和Ⅱ之间增加了如下图所示装置。
则A中的试剂应为 ___________ , B中的试剂为____________。
(4)丙同学经过观察后认为:试管中另一现象可证明反应中有乙烯生成,这个现象是:
______________________;为验证这一反应是加成反应而不是取代反应,可用pH试纸来测试反应前后溶液的酸性变化,原理是:_____________________。
(5)处理上述实验后烧瓶中废液,最合理的方法是______________(填选项)。
A.废液经冷却后倒入下水道中 B.废液倒入空废液缸中
C.将水加入烧瓶中稀释后倒入废液缸 D.废液倒入盛有水的塑料桶中,经处理后再倒入下水道
(1)将一束灼热的细铜丝立刻放进盛有氯气的集气瓶中,产生的现象是,反应的方程式是。若将一束擦亮的细铜丝伸进装有硫蒸气的大试管内,产生的现象是,反应的方程式是,由此得出Cl2与S的氧化性比较是。
(2)某学生在做铜丝在硫蒸气中燃烧的实验时,先将铜丝用砂纸磨光,在酒精灯上预热后迅速插入试管内靠近熔化的硫的液面上方,结果未见铜丝燃烧。实验失败的可能原因是:①,②。
(3)汞蒸气有毒。①万一把汞洒出,可以在溅洒有微细汞滴的部位撒一层硫磺粉,这时发生反应的化学方程式是:。②室内有汞蒸气时,应进行通风以降低汞蒸气浓度,这时通风口装在墙的(填“上”或“下”)部的效率高。
(4)举出两个实验事实,说明氧的非金属性比氟弱:①;②。
在下图装置中,烧瓶中充满干燥气体A,将滴管中的液体B挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹,尖嘴管有液体呈喷泉状喷出,最终几乎充满烧瓶。
(1)若A为HCl气体,B为石蕊试液,则形成红色的喷泉。试分析红色喷泉形成的原因。
(2)请你根据喷泉形成的原理,选择适当的A和B来完成喷泉实验(至少通过三种途径且其中一种喷泉为有色)。将你的选择填入下表。
| A |
B |
喷泉颜色 |
|
| 途径1 |
|||
| 途径2 |
|||
| 途径3 |
(3)已知气体压强p、体积V、温度T、物质的量n之间的关系可用克拉珀龙方程式表示:pV=nRT(R为常数).你能否根据此关系再找出能够完成喷泉实验的其他条件?
图2-27为短周期元素组成的中学常见A—J 10种物质的转换关系。已知A、B、C、D均为单质,通常状况下只有A、C、D为气态。它们在一定条件下发生图示化学反应,得到E—J等化合物(图中物质的状态均为常温常压下)。
图2-27
有关反应的化学计量关系为:
①A与B按物质的量之比n(A)/n(B)=1/2完全反应生成G
②B与C按物质的量之比n(B)/n(C)=3/1完全反应生成F
③C与D按物质的量之比n(C)/n(D)=1/3完全反应生成E
请填空:
(1)构成上述物质各元素的离子中,电子层结构相同且按其离子半径由大到小排列的顺序是(用离子符号表示)_______________。
(2)物质G的电子式是____________,其化学键类型是____________。
(3)B和C反应生成F的化学方程式为______________________________________________。
(4)实验室中制取E反应的化学方程式为____________________________________________,干燥E时常用干燥剂的名称是____________。
(5)常温下将F投入J中可生成E和一种白色难溶物X,该反应的化学方程式为
______________________________________________;若将I通入J中可生成H和某物质Y,X与Y溶液可发生中和反应,该反应的离子方程式为_________________________________。
A、B、C、D四种元素都是短周期元素,A元素的离子具有黄色的焰色反应。B元素的离子结构和Ne具有相同的电子层排布;5.8 g B的氢氧化物恰好能与100 mL 2 mol·L-1盐酸完全反应;B原子核中质子数和中子数相等。H2在C单质中燃烧产生苍白色火焰。D元素原子的电子层结构中,最外层电子数是次外层电子数的3倍。根据上述条件完成下列问题:
(1)元素C位于第________周期第________族,它的最高价氧化物的化学式为________。
(2)A元素是________,B元素是________,D元素是________。
(3)A与D形成稳定化合物的化学式是________,该化合物中存在化学键类型为________,判断该化合物在空气中是否变质的简单方法是
________________________________________。
(4)C元素的单质有毒,可用A的最高价氧化物对应的水化物的溶液吸收,其离子方程式为______________________________________________________________________________。
某研究性学习小组为证明在同温同压下,相同浓度相同体积的酸性不同的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积。设计的简易实验装置如图2-26所示。该实验的主要操作步骤如下: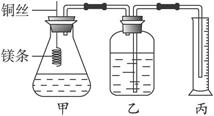
图2-26
①配制浓度均为1 mol·L-1盐酸和醋酸溶液;
②用_________量取10.00 mL 1 mol·L-1盐酸和醋酸溶液分别加入两个锥形瓶中;
③分别称取除去表面氧化膜的镁带a g,并系于铜丝末端,a的数值至少为_________;
④在广口瓶中装足量的水,按图连接好装置,检查装置的气密性;
⑤将铜丝向下移动,使足量镁带浸入酸中(铜丝不与酸接触)至反应完全,记录_____________________________;
⑥反应结束后待温度恢复到室温,若丙中液面高于乙中液面,读取量筒中水的体积前,应___________________________________,读出量筒中水的体积为V mL。
请将上述步骤补充完整并完成下列问题:
(1)用文字表述④检查该装置气密性的操作与观察方法:_______________________________。
(2)本实验中应选用______________(填序号)的量筒。
A.100 mL B.200 mL C.500 mL
(3)若水蒸气的影响忽略不计,在实验室条件下,气体摩尔体积的计算式为:
Vm=_________________。
(4)上述速率不等的原因是_______________________________________________________,
铜丝不与酸接触的原因是_______________________________________________________。